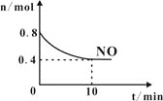
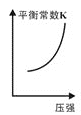
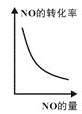
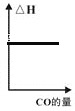
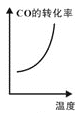
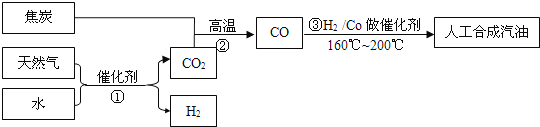
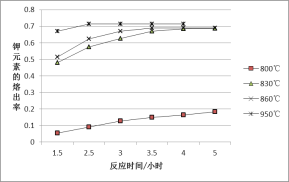
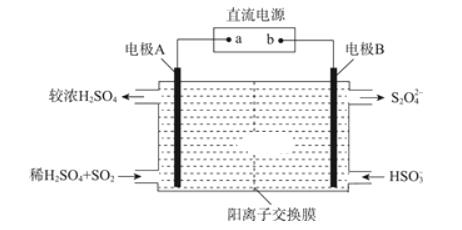
题目内容
【题目】如图是制取和收集某气体的实验装置,该装置可用于

A.用浓盐酸和二氧化锰反应制取Cl2
B.用浓氨水和生石灰反应制取NH3
C.用浓硝酸与铜反应制取NO2
D.用过氧化钠固体和水反应制取O2
【答案】D
【解析】
从反应装置分析知,该装置属于固液混合不加热型装置,所以只能制取固液混合不加热得到的气体;从收集装置分析知,该气体不溶于水,和水不反应。
A. 用二氧化锰和浓盐酸反应制取氯气需要加热,且生成的氯气能和水反应,所以不能用排水法收集,A错误;
B. 用生石灰和浓氨水制取氨气不需加热,但氨气易溶于水,所以不能用排水法收集,B错误;
C. NO2能与水反应生成NO,不能用排水法收集,C错误;
D. 用过氧化钠固体和水制取氧气不需加热,且氧气不易溶于水,所以可以用该实验装置制取氧气,D正确;
故合理选项是D。

【题目】肉桂酸是香料、化妆品、医药、塑料和感光树脂等的重要原料.实验室用下列反应制取肉桂酸.
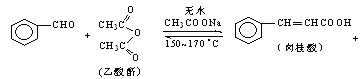 CH3COOH
CH3COOH
药品物理常数
苯甲醛 | 乙酸酐 | 肉桂酸 | 乙酸 | |
溶解度(25℃,g/100g水) | 0.3 | 遇热水水解 | 0.04 | 互溶 |
沸点(℃) | 179.6 | 138.6 | 300 | 118 |
填空:
合成:反应装置如图所示.向三颈烧瓶中先后加入研细的无水醋酸钠、苯甲醛和乙酸酐,振荡使之混合均匀. 在150~170℃加热1小时,保持微沸状态.
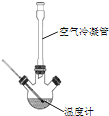
(1)空气冷凝管的作用是__.
(2)该装置的加热方法是__.加热回流要控制反应呈微沸状态,如果剧烈沸腾,会导致肉桂酸产率降低,可能的原因是______.
(3)不能用醋酸钠晶体(CH3COONa3H2O)的原因是______.
粗品精制:将上述反应后得到的混合物趁热倒入圆底烧瓶中,进行下列操作:
反应混合物![]()
![]()
![]()
![]()
![]() 肉桂酸晶体
肉桂酸晶体
(4)加饱和Na2CO3溶液除了转化醋酸,主要目的是_______.
(5)操作I是__;若所得肉桂酸晶体中仍然有杂质,欲提高纯度可以进行的操作是__(均填操作名称).
(6)设计实验方案检验产品中是否含有苯甲醛_______.