题目内容
一定质量的镁、铝合金与硝酸溶液恰好完全反应,得硝酸盐溶液和NO2、N2O4、NO的混合气体,这些气体与标准状况下3.36L氧气混合后通入水中,所有气体恰好完全被水吸收生成硝酸。若向所得硝酸盐溶液中加入2mol/L NaOH溶液至沉淀最多时停止加入,将所产生沉淀滤出,向滤液加水稀释至500ml,此时所得溶液物质的量浓度为
| A.0.5mol/L | B.1mol/L | C.1.2mol/L | D.2mol/L |
C
试题分析:根据电子守恒和电荷守恒计算,金属失去电子数等于氧气得到电子数(可以认为硝酸起到转移电子的作用),金属失去多少电子带多少单位正电荷,在溶液中需结合相同数目的硝酸根离子,最终生成硝酸钠,故硝酸钠的量为n(NaNO3)= 4n(O2)=3.36÷22.4×4=0.6mol c(NaNO3)= 0.6÷0.5="1.2" mol/L

练习册系列答案
相关题目
 mol
mol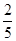 mol
mol mol
mol mol
mol mol
mol