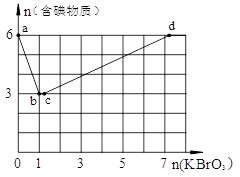
题目内容
工业上常利用反应 3Cl2 + 6KOH(热) → KClO3 + 5KCl + 3H2O 制取KClO3(混有KClO)。实
验室模拟上述制备:在含溶质14mol的KOH(aq,热)中通入一定量Cl2,充分反应后,测得
溶液中n(Cl-)=11mol;将此溶液低温蒸干,得到的固体中KClO3的物质的量可能为
验室模拟上述制备:在含溶质14mol的KOH(aq,热)中通入一定量Cl2,充分反应后,测得
溶液中n(Cl-)=11mol;将此溶液低温蒸干,得到的固体中KClO3的物质的量可能为
| A.2.20 | B.2.33 | C.2.00 | D.0.50 |
C
试题分析: 反应一:3Cl2 + 6KOH(热) → KClO3 + 5KCl + 3H2O;反应二:如果是生成KClO和KCl,则有Cl2 + 2KOH→ KClO+ KCl + H2O,根据电子守恒,当有n(Cl-)=11mol时,得到电子量为11mol,如果全生成KClO3,其物质的量为11/5=2.2mol,如果全生成KClO,则物质的量为11mol,但这不符合钾原子守恒,根据反应二KClO和KCl的物质的量始终相同,即生成KClO的物质的量最多为7mol,此时必生成氯离子为7mol,但n(Cl-)=11mol,故还有4mol是发生了反应一生成,根据电子守恒,生成 KClO3 4/5=0.8mol,所以生成KClO3的量在0.8—2.2之间,故选C。

练习册系列答案
 能力评价系列答案
能力评价系列答案 唐印文化课时测评系列答案
唐印文化课时测评系列答案
相关题目
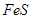 与一定浓度的
与一定浓度的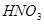 反应,生成
反应,生成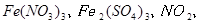
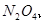
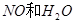 ,当
,当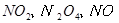 的物质的量之比为
的物质的量之比为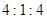 时,实际参加反应的
时,实际参加反应的