题目内容
【题目】工业上以煤和水为原料通过一系列转化可变为清洁能源氢气或工业原料甲醇。
![]() 已知:
已知:![]()
![]()
![]()
![]()
![]()
![]()
则碳与水蒸气反应![]() 的
的![]() ________。
________。
![]() 工业上也可以仅利用碳和水蒸气反应得到的
工业上也可以仅利用碳和水蒸气反应得到的![]() 和
和![]() 进一步合成甲醇,反应方程式为:
进一步合成甲醇,反应方程式为:![]()
![]()
![]() 工业上此生产过程中
工业上此生产过程中![]() 和
和![]() 的转化率________
的转化率________![]() 填“前者大”、“后者大”、“一样大”或“无法判断”
填“前者大”、“后者大”、“一样大”或“无法判断”![]() ;为了既提高甲醇的产率又加快反应速率,可以采取的措施是________。
;为了既提高甲醇的产率又加快反应速率,可以采取的措施是________。
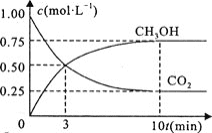
![]() 在一恒温恒容密闭容器中充入
在一恒温恒容密闭容器中充入![]() 和
和![]() 进行上述反应。测得
进行上述反应。测得![]() 和
和![]() 浓度随时间变化如图所示。该温度下的平衡常数为________
浓度随时间变化如图所示。该温度下的平衡常数为________![]() 保留三位有效数字
保留三位有效数字![]() 。
。
![]() 改变温度,使反应
改变温度,使反应![]() 中的所有物质都为气态。起始温度体积相同
中的所有物质都为气态。起始温度体积相同![]() 、
、![]() 密闭容器
密闭容器![]() ,反应过程中部分数据见下表:
,反应过程中部分数据见下表:
反应时间 |
|
|
|
| |
反应Ⅰ 恒温恒容 |
| 2 | 6 | 0 | 0 |
|
| ||||
| 1 | ||||
| 1 | ||||
反应Ⅱ 绝热恒容 |
| 0 | 0 | 2 | 2 |
①达到平衡时,反应Ⅰ、反应Ⅱ对比:平衡常数![]() Ⅰ
Ⅰ![]() ________
________![]() Ⅱ
Ⅱ![]() 填“
填“![]() ”、“
”、“![]() ”或“
”或“![]() ”,下同
”,下同![]() ;平衡时
;平衡时![]() 的浓度
的浓度![]() ________
________![]() Ⅱ
Ⅱ![]() 。
。
![]() 对反应
对反应![]() ,前
,前![]() 内的平均反应速率
内的平均反应速率![]() ________,若
________,若![]() 时只向容器中再充入
时只向容器中再充入![]() 和
和![]() ,则平衡________移动
,则平衡________移动![]() 填“正向”、“逆向”或“不”
填“正向”、“逆向”或“不”![]() 。
。
【答案】![]() 后者大 增大压强或增大CO
后者大 增大压强或增大CO![]() 和H
和H![]() 的浓度
的浓度 ![]()
![]()
![]()
![]() 不
不
【解析】
(1)①C(s)+O2(g)=CO2(g)△H1
②2H2(g)+O2(g)=2H2O (l)△H2
③H2O (l)=H2O (g)△H3
结合盖斯定律计算,①-②-2×③得到碳与水蒸气反应的热化学方程式;
(2)①可逆反应中增大一种反应物浓度可以提高另一种反应物转化率;
依据CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H<0为气体体积减小的、放热反应特点结合影响化学平衡移动的因素解答;
②计算平衡时氢气、水的浓度,再根据K=![]() 计算平衡常数;
计算平衡常数;
(3)①CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H<0,反应Ⅰ是恒温恒容容器,Ⅱ为恒容绝热,反应是放热反应,图表中反应ⅠⅡ若恒温恒容达到相同平衡状态,Ⅱ为逆向恒容绝热,温度降低,平衡正向进行,平衡常数增大,甲醇浓度增大;
②反应速率V=![]() 计算得到氢气反应速率,速率之比等于化学方程式计量数之比计算甲醇反应速率;依据平衡三段式列式计算分析平衡状态的物质的量得到平衡浓度,计算此时平衡常数,若30min时只向容器中再充入1mol CO2(g)和1mol H2O(g),计算此时浓度商和平衡常数比较判断反应进行方向.
计算得到氢气反应速率,速率之比等于化学方程式计量数之比计算甲醇反应速率;依据平衡三段式列式计算分析平衡状态的物质的量得到平衡浓度,计算此时平衡常数,若30min时只向容器中再充入1mol CO2(g)和1mol H2O(g),计算此时浓度商和平衡常数比较判断反应进行方向.
![]()
![]()
![]()
结合盖斯定律计算,![]() 得到碳与水蒸气反应的热化学方程式为:
得到碳与水蒸气反应的热化学方程式为:![]() 的
的![]() ,
,
故答案为:![]() ;
;
![]() 生成二氧化碳和氢气的物质的量之比为1:2,而
生成二氧化碳和氢气的物质的量之比为1:2,而![]() ,二氧化碳和氢气物质的量之比为1:3,相当于增大二氧化碳浓度,所以氢气的转化率大于二氧化碳转化率;
,二氧化碳和氢气物质的量之比为1:3,相当于增大二氧化碳浓度,所以氢气的转化率大于二氧化碳转化率;
![]() 为气体体积减小的、放热反应,要想提高甲醇的产率加快反应速率可采取的措施是增大压强或增大
为气体体积减小的、放热反应,要想提高甲醇的产率加快反应速率可采取的措施是增大压强或增大![]() 和
和![]() 的浓度;
的浓度;
故答案为:后者大;增大压强或增大![]() 和
和![]() 的浓度;
的浓度;
![]() 平衡时甲醇为
平衡时甲醇为![]() 、二氧化碳为
、二氧化碳为![]() ,则:
,则:
![]()
起始浓度![]() : 1 3 0 0
: 1 3 0 0
变化浓度![]() :
:![]()
![]()
![]()
![]()
平衡浓度![]() :
:![]()
![]()
![]()
![]()
则平衡常数![]()
故答案为:![]() ;
;
![]() ,反应Ⅰ是恒温恒容容器,Ⅱ为恒容绝热,反应是放热反应,图表中反应Ⅱ若恒温恒容达到相同平衡状态,Ⅱ为逆向恒容绝热,温度降低,平衡正向进行,平衡常数增大,甲醇浓度增大;
,反应Ⅰ是恒温恒容容器,Ⅱ为恒容绝热,反应是放热反应,图表中反应Ⅱ若恒温恒容达到相同平衡状态,Ⅱ为逆向恒容绝热,温度降低,平衡正向进行,平衡常数增大,甲醇浓度增大;
故答案为:![]() ;
;![]() ;
;
![]()
![]()
起始量![]() 13 0 0
13 0 0
变化量![]()
![]()
![]()
![]()
![]()
30min量![]()
![]()
![]()
![]()
对反应I,前10min内的平均反应速率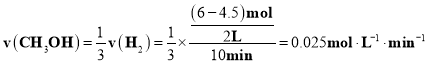 ;平衡常数
;平衡常数![]() ,
,
若30min时只向容器中再充入![]() 和
和![]() ,
,
![]()
浓度![]() 1
1 ![]()
![]() 1
1
浓度商![]() ,所以平衡不移动;
,所以平衡不移动;
故答案为:![]() ;不。
;不。

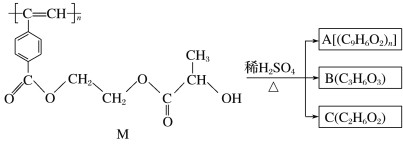
【题目】常温下,1mol化学键断裂形成气态原子所需要的能量用![]() 表示。结合表中信息判断下列说法不正确的是( )
表示。结合表中信息判断下列说法不正确的是( )
共价键 | H-H | F-F | H-F | H-Cl | H-I |
E(kJ/mol) | 436 | 157 | 568 | 432 | 298 |
A. 432kJ/mol>E(H-Br)>298kJ/mol B. 表中最稳定的共价键是H-F键
C. H2(g)→2H(g) △H=+436kJ/mol D. H2(g)+F2(g)=2HF(g) △H=-25kJ/mol
【题目】中和热的测定是重要的定量实验。取0.55mol/L的NaOH溶液50mL与0.50mol/L的盐酸50mL置于下图所示的装置中进行中和热的测定实验,回答下列问题:

(1)从图中实验装置看,其中尚缺少的两种玻璃用品是_____________,为保证该实验成功,该同学采取了许多措施,如图的泡沫塑料块的作用在于________________
(2)倒入NaOH溶液的正确操作是:_______(从下列选出)。
A.沿玻璃棒缓慢倒入 B.分三次少量倒入 C.一次迅速倒入
(3)实验记录数据如表
项目 | 反应起始温度T1(℃) | 终止温度T2(℃) | T2-T1 | ||
HCl | NaOH | 平均温度 | |||
第1次 | 26.2 | 26.0 | 29.4 | ||
第2次 | 27.0 | 27.4 | 32.2 | ||
第3次 | 25.9 | 25.9 | 29.1 | ||
第4次 | 26.4 | 26.2 | 29.7 | ||
设0.55mol/LNaOH溶液和0
(4)不能用醋酸代替盐酸做此实验,原因是____________________。
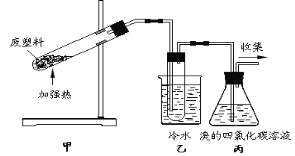
【题目】实验室以苯甲醛为原料制备间溴苯甲醛的反应如下:
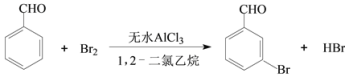
已知:(1)间溴苯甲醛温度过高时易被氧化。
(2)溴、苯甲醛、1,2-二氯乙烷、间溴苯甲醛的沸点见下表:
物质 | 溴 | 苯甲醛 | 1,2-二氯乙烷 | 间溴苯甲醛 |
沸点/℃ | 58.8 | 179 | 83.5 | 229 |
步骤1:将一定配比的无水AlCl3、1,2-二氯乙烷和苯甲醛充分混合后装入三颈烧瓶(如右图所示),缓慢滴加经浓硫酸干燥过的足量液溴,控温反应一段时间,冷却。

步骤2:将反应混合物缓慢加入一定量的稀盐酸中,搅拌、静置、分液。有机层用10% NaHCO3溶液洗涤。
步骤3:经洗涤的有机层加入适量无水MgSO4固体,放置一段时间后过滤出
MgSO4nH2O晶体。
步骤4:减压蒸馏有机层,收集相应馏分。
(1)实验装置中冷凝管的主要作用是_____,锥形瓶中应为_____(填化学式)溶液。
(2)步骤1反应过程中,为提高原料利用率,适宜的温度范围为(填序号)_______。
A.>229℃ B.58.8℃~179℃ C.<58.8℃
(3)步骤2中用10% NaHCO3溶液洗涤,是为了除去溶于有机层的___(填化学式)。
(4)步骤3中加入无水MgSO4固体的作用是_____。
(5)步骤4中采用减压蒸馏,是为了防止______。
(6)若实验中加入了5.3 g苯甲醛,得到3.7 g间溴苯甲醛。则间溴苯甲醛产率为______。