题目内容
19. 已知A、B、C、D、E、F都是周期表中前 四周期的元素,它们的核电荷数依次增大,其中A、B、C、D、E为不同主族的元素.A、C的最外层电子数都是其电子层数的2倍,B的电负性大于C,透过蓝色钴玻璃观察E的焰色反应为紫色,F的基态原子中有4个未成对电子.
已知A、B、C、D、E、F都是周期表中前 四周期的元素,它们的核电荷数依次增大,其中A、B、C、D、E为不同主族的元素.A、C的最外层电子数都是其电子层数的2倍,B的电负性大于C,透过蓝色钴玻璃观察E的焰色反应为紫色,F的基态原子中有4个未成对电子.(1)基态的F3+外围电子排布式是1s22s22p63s23p63d5.
(2)B的气态氢化物在水中的溶解度远大于A、C的气态氢化物,原因是NH3与H2O分子间存在氢键,其他分子与H2O分子间不存在氢键.
(3)化合物FD3是棕色固体、易潮解、100℃左右时升华,它的晶体类型是分子晶体; 化合物ECAB中的中的阴离子与AC2互为等电子体,该阴离子的电子式是[
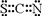 ]-,其中心原子采用sp杂化.
]-,其中心原子采用sp杂化.(4)黄血盐是由A、B、元素形成的配位化合物E4[F(AB)6],易溶于水,广泛用作食盐添加剂(抗结剂).请写出黄血盐的化学式K4[Fe(CN)6],1mol AB-中含有π键的数目为2NA,黄血盐晶体中各种微粒间的作用力不涉及def(填序号).
a.离子键 b.共价键 c.配位键 d.金属键 e.氢键 f.分子间的作用力
(5)FD3与ECAB溶液按不同比例混合,可得到多种配位数均为6(水分子可作配体)的配合物的溶液,其中两者按物质的量1:5混合形成的配合物的化学式是K2[Fe(SCN)5H2O].
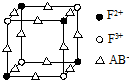
(6)化合物EF[F(AB)6]是一种蓝色晶体,如图表示其晶胞的$\frac{1}{8}$(E+未画出).该蓝色晶体的一个晶胞中E+的个数为4.
(7)E单质的晶胞中,若设该晶胞的密度为a g/cm3,阿伏加得罗常数为NA,E原子的摩尔质量为M,则表示E原子半径为$\frac{\sqrt{3}}{4}\root{3}{\frac{2M}{a{N}_{A}}}$cm.
分析 A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数依次增大,其中A、B、C、D、E为不同主族的元素;A、C的最外层电子数都是其电子层数的2倍,则A是C元素,C是S元素,透过蓝色钴玻璃观察E的焰色反应为紫色,E是K元素,D的原子序数介于S与K元素之间,故D为Cl元素,B的电负性大于C,且B的原子序数小于C,属于不同主族,所以B是N元素;F位于第四周期,基态原子中有4个未成对电子,外围电子排布为3d64s2,则F是Fe元素,据此进行解答.
解答 解:A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数依次增大,其中A、B、C、D、E为不同主族的元素;A、C的最外层电子数都是其电子层数的2倍,则A是C元素,C是S元素,透过蓝色钴玻璃观察E的焰色反应为紫色,E是K元素,D的原子序数介于S与K元素之间,故D为Cl元素,B的电负性大于C,且B的原子序数小于C,属于不同主族,所以B是N元素,F位于第四周期,基态原子中有4个未成对电子,外围电子排布为3d64s2,则F是Fe元素.
(1)铁离子的核外电子排布式为:1s22s22p63s23p63d5;
故答案为:1s22s22p63s23p63d5;
(2)N、O、F原子易形成氢键,氢键的存在影响物质的熔沸点和溶解性,所以NH3与H2O分子间存在氢键,其它分子与H2O分子间不存在氢键,所以氨气的溶解性大;
故答案为:NH3与H2O分子间存在氢键,其他分子与H2O分子间不存在氢键;
(3)氯化铁的熔点较低,为分子晶体,把二硫化碳分子中的一个硫原子换成N原子,则硫氰根离子的电子式为:[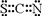 ]-,其中心原子碳原子价层电子对个数=σ键个数+孤电子对个数=2+$\frac{1}{2}$(4-2×2)=2,采取sp杂化,
]-,其中心原子碳原子价层电子对个数=σ键个数+孤电子对个数=2+$\frac{1}{2}$(4-2×2)=2,采取sp杂化,
故答案为:分子晶体,[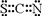 ]-;sp;
]-;sp;
(4)黄血盐的化学式K4[Fe(CN)6],CN-与氮气互为等电子体,CN-中存在C≡N三键,故1molCN-中含有π键的数目为2NA,黄血盐晶体中含有离子键、配位键、共价键,没有金属键、氢键和分子间的作用力,所以def正确,
故答案为:K4[Fe(CN)6];2NA;def;
(5)FD3为FeCl3,ECAB为KSCN,二者可得到多种配位数均为6(水分子可作配体)的配合物的溶液,其中两者按物质的量1:5混合形成的配合物的化学式为:K2[Fe(SCN)5H2O],
故答案为:K2[Fe(SCN)5H2O];
(6)晶胞的$\frac{1}{8}$(E+未画出)中,亚铁离子个数=4×$\frac{1}{8}$=$\frac{1}{2}$,铁离子个数=4×$\frac{1}{8}$=$\frac{1}{2}$,CN-离子个数=12×$\frac{1}{4}$,所以晶胞中亚铁离子个数是$\frac{1}{2}$×8=4,铁离子个数是$\frac{1}{2}$×4=4,CN-离子个数=3×8=24,化合物EF[F(AB)6]是KFe[Fe(CN)6],根据各离子的个数比知,晶胞中钾离子个数是4,
故答案为:4;
(7)E为K元素,金属钾的晶胞结构为体心立方,晶胞中K原子数目为:1+8×$\frac{1}{8}$=2,阿伏加德罗常数为NA,K原子的摩尔质量为M,故晶胞质量为:$\frac{2M}{{N}_{A}}$,
设K原子半径为r,设晶胞棱长为l,晶胞中体对角线为4r,则(4r)2=l2+l2+l2,则l=$\frac{4}{3}\sqrt{3}$r,晶胞体积V=l3=($\frac{4}{3}\sqrt{3}$r)3,若设该晶胞的密度为ag/cm3,则($\frac{4}{3}\sqrt{3}$r)3×a=$\frac{2M}{{N}_{A}}$,整理得:r=$\frac{\sqrt{3}}{4}\root{3}{\frac{2M}{a{N}_{A}}}$,
故答案为:$\frac{\sqrt{3}}{4}\root{3}{\frac{2M}{a{N}_{A}}}$.
点评 本题考查物质结构与性质,题目解答较大,涉及元素推断、核外电子排布规律、分子结构与性质、杂化理论、晶胞计算,(7)中计算为易错点、难点,根据晶体结构确定原子半径与晶胞棱长关系是关键,注意利用均摊法进行晶胞中原子数目计算.

| A. | 生石灰-Ca(OH)2 | B. | 醋酸-C2H4O2 | C. | 石膏-2CaSO4•H2O | D. | 小苏打-KHCO3 |
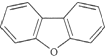 ,其一氯代物有( )
,其一氯代物有( )| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
| R | X | |||
| W | Y | Z |
| A. | W的氧化物属于酸性氧化物,与一切酸都不能发生反应 | |
| B. | Z的单质可用于杀灭田鼠 | |
| C. | Y、Z的最高价氧化物对应的水化物的酸性:Y>Z | |
| D. | X、Y的氢化物的沸点:Y>X |
| A. | 在强碱性溶液中:Na+、K+、AlO2-、Cl- | |
| B. | pH=1的溶液中:HCO3-、NH4+、NO3-、Ca2+ | |
| C. | 无色溶液中:Cu2+、NO3-、Cl-、H+ | |
| D. | 无色溶液中:Na+、K+、ClO-、SO32- |


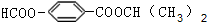 .
.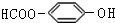 . (写结构简式)
. (写结构简式)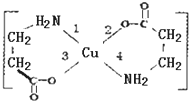 II.二甘氨酸合铜(II)是最早被发现的电中性内配盐,它的结构如图:
II.二甘氨酸合铜(II)是最早被发现的电中性内配盐,它的结构如图: