��Ŀ����
����Ŀ���������繤ҵ���õķ�չ���˿ڵľ���,ȫ����Դ���ż�������������Խ��Խ���ص�����,��ν��ʹ�����CO2�ĺ�������Ч�ؿ�������CO2������ȫ������ձ����ӡ�
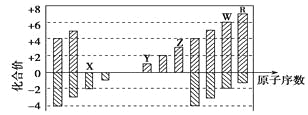
��1����ͼΪC����������ı仯��ϵͼ,�����仯���û���Ӧ,���仯ѧ����ʽ��Ϊ;
��2����ú��Ϊȼ�Ͽ�ͨ����������;����
;������C��s����O2��g��===CO2��g����H1��0����
;���������Ƴ�ˮú����C��s����H2O��g��===CO��g����H2��g����H2��0����
��ȼ��ˮú����2CO��g����O2��g��===2CO2��g����H3��0����
2H2��g����O2��g��===2H2O��g����H4��0����
��;�����ų�������________��������������������������С������;�����ų���������
��3���״���һ�ֿ�������Դ,���п�����Ӧ�õĹ���ǰ��,��֪��Ӧ2CH3OH��g��![]() CH3OCH3��g����H2O��g��ij�¶��µ�ƽ�ⳣ��Ϊ400�����¶��£����ܱ������м���CH3OH����Ӧ��ijʱ�̲�ø���ֵ�Ũ�����£�
CH3OCH3��g����H2O��g��ij�¶��µ�ƽ�ⳣ��Ϊ400�����¶��£����ܱ������м���CH3OH����Ӧ��ijʱ�̲�ø���ֵ�Ũ�����£�
���� | CH3OH | CH3OCH3 | H2O |
Ũ��/��mol��L��1�� | 0��44 | 0��6 | 0��6 |
�Ƚϴ�ʱ�����淴Ӧ���ʵĴ�С��v��____v��������>����<��������������
��4������Һ����ʾ���Ĺ�����ʹ�õĻ�ѧ��ϴ��NF3��һ���������壬��洢������������CO2��12000��20000�����ڴ����е������ɳ���740��֮�ã������Ǽ��ֻ�ѧ���ļ��ܣ�
��ѧ�� | N��N | F��F | N��F |
����/kJ��mol��1 | 941��7 | 154��8 | 283��0 |
��ӦN2��g����3F2��g���T2NF3��g������H=
��5��25����101kPaʱ����֪��
2H2O��g���TO2��g��+2H2��g����H1
Cl2��g��+H2��g���T2HCl��g����H2
2Cl2��g��+2H2O��g���T4HCl��g��+O2��g����H3
����H3����H1����H2��Ĺ�ϵ��ȷ����
A����H3=��H1+2��H2B����H3=��H1+��H2
C����H3=��H1��2��H2D����H3=��H1����H2
��6�����������ھ�������,����ˮ����,������ҵ�������ΪƯ�����������������������ҿ������������е��ʷ�Ӧ����6Ag��s��+O3��g��=3Ag2O��s����H=-235��8kJ��mol-1,
��֪:2Ag2O��s��=4Ag��s��+O2��g����H=+62��2kJ��mol-1,
��O3ת��ΪO2���Ȼ�ѧ����ʽΪ��
���𰸡�
��1��C+H2O![]() H2+CO����������,����CuO��FeO��SiO2�ȷ�Ӧ��
H2+CO����������,����CuO��FeO��SiO2�ȷ�Ӧ��
��2��������
��3��>��
��4����H=-291��9kJ��mol-1
��5��A��
��6��2O3��g��=3O2��g����H=-285kJ��mol-1
��������
�����������1�������û���Ӧ������̼��ˮ������Ӧ����һ����̼��������������������ﷴӦ����Ӧ�Ļ�ѧ����ʽΪ��C+H2O![]() CO+H2���ʴ�Ϊ��C+H2O
CO+H2���ʴ�Ϊ��C+H2O![]() CO+H2��
CO+H2��
��2���ɸ�˹���ɿ�֪������һ����Ӧ���Էֲ����У��������Ӧ�����ջ�ų��������ܺ��������Ӧһ�η���ʱ���ջ�ų���������ͬ���ʴ�Ϊ�����ڣ�
��3�����÷�Ӧ��ƽ�ⳣ������ʽΪ��K=![]() ��������Ũ�ȴ���ƽ�ⳣ������ʽ��
��������Ũ�ȴ���ƽ�ⳣ������ʽ��![]() =1��86��400���ʷ�Ӧ������Ӧ������У�����Ӧ���ʴ����淴Ӧ���ʣ��ʴ�Ϊ������
=1��86��400���ʷ�Ӧ������Ӧ������У�����Ӧ���ʴ����淴Ӧ���ʣ��ʴ�Ϊ������
��4����ӦN2��g��+3F2��g����2NF3��g����H=��941��7+3��154��8-283��0��6��KJmol-1=-291��9KJmol-1���ʴ�Ϊ����H=-291��9kJ��mol-1��
��5����2H2O��g��=2H2��g��+O2��g����H1����H2��g��+Cl2��g��=2HCl��g����H2����2Cl2��g��+2H2O��g��=4HCl��g��+O2��g����H3����Ӧ��=��+2�������ɸ�˹���ɿ�֪����H3=��H1+2��H2����ѡA��
��6������6Ag��s��+O3��g���T3Ag2O��s������H=-235��8kJmol-1������2Ag2O��s���T4Ag��s��+O2��g������H=+62��2kJmol-1�����ݸ�˹���ɿ�֪���2+���3�ɵõ���2O3��g���T3O2��g������Ӧ����H=��-235��8kJmol-1����2+��+62��2kJmol-1����3=-285kJ/mol���ʴ�Ϊ��2O3��g���T3O2��g����H=-285kJ/mol��