题目内容
14.对羟基苯甲酸乙酯又称尼泊金乙酯,是一种常见的食品添加剂及防腐剂,其生产过程如下(反应条件未全部注明)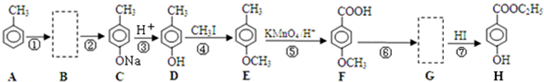
回答下列问题:
(1)反应①的条件为甲苯与液溴混合,用FeBr3作催化剂(或Br2/Fe),反应④的反应类型为取代反应.
(2)该过程中反应④⑦的作用是防止酚羟基被氧化.
(3)G的结构简式为
 .
.(4)对羟基苯甲酸(
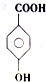 )在一定条件下发生聚合反应生成高分子化合物,写出该反应的化学方程式
)在一定条件下发生聚合反应生成高分子化合物,写出该反应的化学方程式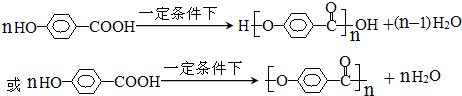 .
.(5)F的同分异构体很多,其中符合下列条件的有3种.
①遇到FeCl3溶液出现特殊颜色;②能发生水解反应;③能发生银镜反应;④无-CH3结构.上述同分异构体中,核磁共振氢谱显示其有5种峰的结构简式为
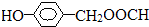 .
.
分析 根据题中各物质转化关系,甲苯在甲基对位与卤素(常见为溴)发生取代生成B为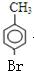 ,B碱性水解,发生取代反应生成C,C酸化得D,D与碘甲烷发生取代反应生成E,E被氧化得到F,比较F和H的结构可知,F发生酯化反应得G为
,B碱性水解,发生取代反应生成C,C酸化得D,D与碘甲烷发生取代反应生成E,E被氧化得到F,比较F和H的结构可知,F发生酯化反应得G为 ,G与HI发生取代反应得H,据此答题.
,G与HI发生取代反应得H,据此答题.
解答 解:根据题中各物质转化关系,各反应如下:甲苯在甲基对位与卤素(常见为溴)发生取代反应,反应①的化学方程式为: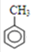 +Br2$\stackrel{FeBr_{3}}{→}$
+Br2$\stackrel{FeBr_{3}}{→}$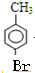 +HBr;B碱性水解,反应②的化学方程式为:
+HBr;B碱性水解,反应②的化学方程式为: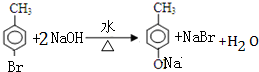 ;C酸化得D,酸为盐酸、硫酸等酸性强于苯酚的酸即可,所以反应③的化学方程式为:
;C酸化得D,酸为盐酸、硫酸等酸性强于苯酚的酸即可,所以反应③的化学方程式为: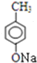 +HCl→
+HCl→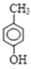 +NaCl;D与碘甲烷发生取代反应,反应④的化学方程式为:
+NaCl;D与碘甲烷发生取代反应,反应④的化学方程式为: +CH3I→
+CH3I→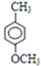 +HI;苯环连接的甲基被氧化为-COOH,反应⑤的化学方程式为:
+HI;苯环连接的甲基被氧化为-COOH,反应⑤的化学方程式为: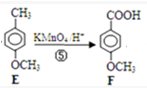 ;F发生酯化反应得G,反应⑥的化学方程式为:
;F发生酯化反应得G,反应⑥的化学方程式为: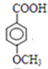 +CH3CH2COOH
+CH3CH2COOH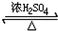
 +H2O;G与HI发生取代反应,反应⑦的化学方程式为:
+H2O;G与HI发生取代反应,反应⑦的化学方程式为: +HI→
+HI→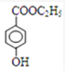 +CH3I;
+CH3I;
(1)在光照条件下可取代烃基上的H,反应①为甲苯发生取代反应生成 的反应,反应条件应为液溴、催化剂(FeBr3),反应④的反应类型是取代反应,
的反应,反应条件应为液溴、催化剂(FeBr3),反应④的反应类型是取代反应,
故答案为:甲苯与液溴混合,用FeBr3作催化剂(或Br2/Fe);取代反应;
(2)由于苯环连接的甲基被氧化为-COOH,而酚羟基也比较容易被氧化,所以该过程中反应④⑦这两步的作用是保护酚羟基不被氧化,
故答案为:防止酚羟基被氧化;
(3)根据上面的分析可知,有机物G的结构简式为 ,故答案为:
,故答案为: ;
;
(4) 中含有羧基、羟基,发生缩聚反应生成
中含有羧基、羟基,发生缩聚反应生成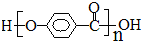 ,反应方程式为:
,反应方程式为: ,
,
故答案为: ;
;
(5)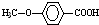 的同分异构体符合:遇到FeCl3溶液出现显色现象,说明含有酚羟基;能发生水解反应,能发生银境反应,结合结构简式可知,应含有甲酸形成的酯基,且无-CH3结构,只能含有2个取代基为-OH、-CH2OOCH,则苯环上有2种H原子,则2个不同的取代基处于邻、间、对位,所以有3种同分异构体,上述同分异构体中核磁共振氢谱显示其有5种峰的结构简式为
的同分异构体符合:遇到FeCl3溶液出现显色现象,说明含有酚羟基;能发生水解反应,能发生银境反应,结合结构简式可知,应含有甲酸形成的酯基,且无-CH3结构,只能含有2个取代基为-OH、-CH2OOCH,则苯环上有2种H原子,则2个不同的取代基处于邻、间、对位,所以有3种同分异构体,上述同分异构体中核磁共振氢谱显示其有5种峰的结构简式为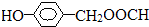 ,
,
故答案为:3;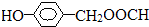 .
.
点评 本题以甲苯生产对羟基苯甲酸乙酯为载体考查官能团性质、同分异构体、有机合成、有机物推断等,涉及苯的同系物、卤代烃、醇、酚、羧酸等性质与转化,题目难度中等,旨在考查学生对知识的掌握与迁移运用、思维分析等能力.

 高中必刷题系列答案
高中必刷题系列答案| A. | ①② | B. | ②③ | C. | ③④ | D. | ②④ |
| A. | Li、Na、K元素的原子核外电子层数随着核电荷数的增加而减少 | |
| B. | 因为K比Na容易失去电子,所以K比Na的还原性强 | |
| C. | 第二周期元素从Li到F,非金属性逐渐减弱 | |
| D. | O与S为同主族元素,且O比S的非金属性弱 |
| A. | 镁和盐酸反应:2Fe+6H+═2Fe3++3H2↑ | |
| B. | 氯化铁溶液中加入铜片:Fe3++Cu═Fe2++Cu2+ | |
| C. | 氯气通入水中:CI2+H2O═2H++CI-+CIO- | |
| D. | 硫酸溶液中加入氢氧化钡溶液:2H++SO42-+Ba2++2OH-═BaSO4↓+2H2O |
| 选项 | 实验目的 | 实验方案 |
| A | 验证Br2的氧化性强于l2 | 将少量溴水加入Kl溶液中,再加入CCl4,振荡,静置,可观察到下层液体呈紫色 |
| B | 探究石蜡油分解的产物含有烯烃 | 将石蜡油加强热产生的气体通入溴的四氧化碳溶液中 |
| C | 探究蔗糖水解的产物中是否含有葡萄糖 | 取少量蔗糖溶液加稀硫酸,水溶加热几分钟后,再加入新制的氢氧化铜悬浊液并加热 |
| D | 验证Na能置换出醇烃基中的氢 | 向一定量的无水乙醇中加入足量Na,测量生成气体的体积 |
| A. | A | B. | B | C. | C | D. | D |
| A. |  | B. |  | C. | 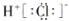 | D. | 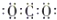 |
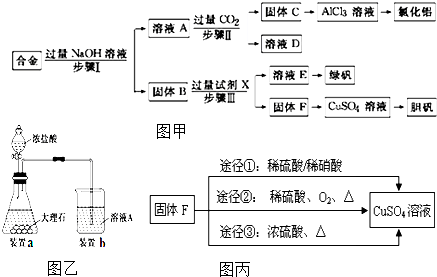
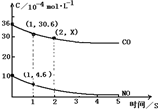 烟气的脱硫(除SO2)和脱硝(除NOx)都是环境科学研究的热点.可以通过氧化还原反应或酸碱反应进行脱硫和脱硝.
烟气的脱硫(除SO2)和脱硝(除NOx)都是环境科学研究的热点.可以通过氧化还原反应或酸碱反应进行脱硫和脱硝.