题目内容
6.用0.1mol/L的Na2SO3溶液40mL,恰好将2×10-3 mol的X2O42-还原,则元素X在还原产物中的化合价是( )| A. | +1 | B. | +2 | C. | +3 | D. | +4 |
分析 根据氧化还原反应中得失电子守恒计算.
解答 解:该反应中Na2SO3为还原剂,SO32-中的S被氧化,变为SO42-,化合价从+4升到+6价,失电子数=0.1mol/L×0.04L×2=0.008mol,
X2O42-为氧化剂,其中X元素化合价降低,开始为+3价,得失电子守恒,得电子数为0.008mol=2×10-3 mol×(3-x)×2,解得x=1,
即元素X在还原产物中的化合价是+1价;
故选:A.
点评 本题考查氧化还原反应的计算,把握氧化还原反应中得失电子守恒为解本题的关键,注意S失去电子,X元素得到电子,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
17.无水氯化镁是制备某种催化剂的中间体.某研究性学习小组设计实验方案进行制取无水氯化镁等实验.请填写下列空白.
[实验一]利用如图实验装置(夹持和加热装置省略),在HCl气流中小心加热MgCl2•6H2O晶体制取无水氯化镁(无水氯化镁易吸水).烧瓶中发生的反应为:NaCl+H2SO4(浓)═NaHSO4+HCl↑

(1)试剂X是浓硫酸.
(2)该实验装置存在一个缺陷是没有尾气处理装置.
[实验二]通过下列步骤,测定实验一所得产物中氯元素含量以确定产物是否含有结晶水:
①称取m1g样品置于烧杯中,充分溶解;②加入足量硝酸银溶液,充分反应后,过滤;③洗涤沉淀,干燥至恒重,称得沉淀质量为m2g.
(3)若步骤③的操作中未洗涤沉淀,将导致测得的氯元素含量偏高(填“偏高”或“偏低”)
(4)若测得m1=10.40,m2=28.70,则所得产品MgCl2•nH2O中n的值为$\frac{1}{2}$.
[实验三]一定条件下,氯化镁与四氯化钛的混合物可作烯烃聚合反应的催化剂.为了探究温度、氯化镁固体的含水量以及粉碎方式对该催化剂催化效果的影响,设计如表对比实验:
注:催化效果用单位时间内每克催化剂得到产品的质量来表示
(5)表中ω=74.45.
(6)从实验1、2可以得出的结论是氯化镁固体含水量越高,催化剂催化效果越差.
(7)设计实验2、3的目的是探究粉碎方式对催化剂催化效果的影响.
[实验一]利用如图实验装置(夹持和加热装置省略),在HCl气流中小心加热MgCl2•6H2O晶体制取无水氯化镁(无水氯化镁易吸水).烧瓶中发生的反应为:NaCl+H2SO4(浓)═NaHSO4+HCl↑

(1)试剂X是浓硫酸.
(2)该实验装置存在一个缺陷是没有尾气处理装置.
[实验二]通过下列步骤,测定实验一所得产物中氯元素含量以确定产物是否含有结晶水:
①称取m1g样品置于烧杯中,充分溶解;②加入足量硝酸银溶液,充分反应后,过滤;③洗涤沉淀,干燥至恒重,称得沉淀质量为m2g.
(3)若步骤③的操作中未洗涤沉淀,将导致测得的氯元素含量偏高(填“偏高”或“偏低”)
(4)若测得m1=10.40,m2=28.70,则所得产品MgCl2•nH2O中n的值为$\frac{1}{2}$.
[实验三]一定条件下,氯化镁与四氯化钛的混合物可作烯烃聚合反应的催化剂.为了探究温度、氯化镁固体的含水量以及粉碎方式对该催化剂催化效果的影响,设计如表对比实验:
| 实验序号 | 氯化镁固体中氯元素含量/% | 温度/℃ | 粉碎方式 | 催化效果/g•g-1 |
| 1 | 70.97 | 20 | 滚动球磨 | 3.9×104 |
| 2 | 74.45 | 20 | 滚动球磨 | 5.0×104 |
| 3 | 74.45 | 20 | 振动球磨 | 5.9×104 |
| 4 | ω | 100 | 振动球磨 | 6.5×104 |
(5)表中ω=74.45.
(6)从实验1、2可以得出的结论是氯化镁固体含水量越高,催化剂催化效果越差.
(7)设计实验2、3的目的是探究粉碎方式对催化剂催化效果的影响.
14.下列不属于普通硅酸盐水泥主要成分的是( )
| A. | 铝酸二钙 | B. | 铝酸三钙 | C. | 硅酸二钙 | D. | 硅酸三钙 |
15.下列化学用语表达正确的是( )
| A. | N2的结构式: | |
| B. | 次氯酸的结构式为:H-Cl-O | |
| C. | 硫离子的核外电子排布式:1s22s22p63s23p6 | |
| D. | NH3的电子式: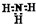 |

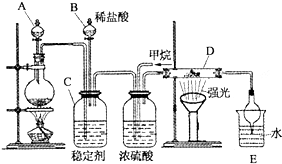 氯及其化合物在合成消毒剂、药物等方面具有广泛用途.二氧化氯(ClO2,黄绿色易溶于水的气体)是高效、低毒的消毒剂,某兴趣小组通过如图装置,对二氧化氯及氯气的性质进行了研究:
氯及其化合物在合成消毒剂、药物等方面具有广泛用途.二氧化氯(ClO2,黄绿色易溶于水的气体)是高效、低毒的消毒剂,某兴趣小组通过如图装置,对二氧化氯及氯气的性质进行了研究: