题目内容
16.反应aA+bB?cC+dD(A,B,C,D均为气体)且a+b>c+d,若反应达到平衡后增大体系压强,则此时V正增大,V逆 增大,而平衡将向正反应方向移动,说明压强增大时刻,V正>V逆,请画出对应的v-t图.分析 反应达到平衡后增大体系压强,则此时V正、V逆都增大,平衡将向气体体积减小的方向移动即正反应方向移动,说明压强增大时刻,V正>V逆,据此画出对应的v-t图.
解答 解:因为反应aA+bB?cC+dD(A,B,C,D均为气体)且a+b>c+d,所以增大体系压强,则此时V正、V逆都增大,平衡将向气体体积减小的方向移动即正反应方向移动,说明压强增大时刻,V正>V逆,则对应的v-t图为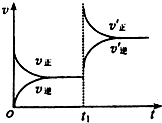 ,故答案为:增大;增大;正反应;>;
,故答案为:增大;增大;正反应;>; .
.
点评 本题考查压强对反应速率及其平衡移动的影响,题目难度不大,本题注意压强对平衡的移动原理.

练习册系列答案
相关题目
11.如表是部分短周期元素的原子半径及主要化合价,根据表中信息,判断以下叙述正确的是( )
| 元素代号 | A | B | C | D | E |
| 原子半径/nm | 0.160 | 0.143 | 0.089 | 0.102 | 0.074 |
| 主要化合价 | +2 | +3 | +2 | +6、-2 | -2 |
| A. | A2+与D2-的核外电子数相等 | |
| B. | B与E形成的化合物具有两性 | |
| C. | 氢化物的稳定性为H2E<H2D | |
| D. | C单质与浓度相等的稀盐酸反应比A快 |
1.质量分数为ω,物质的量浓度为c mol•L-1的NaCl溶液,蒸发溶剂后恢复到原来的温度,若物质的量浓度变为2c mol•L-1,则质量分数变为(蒸发过程中没有晶体析出,且NaCl溶液的密度大于1g/mL)( )
| A. | 等于ω | B. | 大于ω,小于2ω | C. | 小于ω | D. | 无法确定 |
8.下列电解质的水溶液中,微粒种类最多的是( )
| A. | CH3COOH | B. | H2SO4 | C. | H2S | D. | Na2SO4 |
5.下列离子方程式书写正确的是( )
| A. | 向澄清石灰水中滴入少量的NaHCO3溶液:HCO3?+OH?+Ca2+═CaCO3↓+H2O | |
| B. | 用CH3COOH除水垢:CaCO3+2H+=H2O+CO2↑+Ca2+ | |
| C. | 少量SO2通入Ca(ClO)2溶液中:SO2+ClO-+H2O+Ca2+═CaSO4↓+2HClO | |
| D. | 少量的氯气通入溴化亚铁溶液中:Cl2+2Br-═Br2+2Cl- |
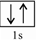
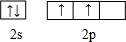 .
.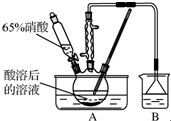 已知:氧化过程中温度需控制在55~60℃,发生的主要反应为C6H12O6+12HNO3$\frac{\underline{\;\;△\;\;}}{\;}$3H2C2O4+9NO2↑+3NO↑+9H2O.
已知:氧化过程中温度需控制在55~60℃,发生的主要反应为C6H12O6+12HNO3$\frac{\underline{\;\;△\;\;}}{\;}$3H2C2O4+9NO2↑+3NO↑+9H2O.