题目内容
17.工业上消除氮氧化物的污染,可用如下反应:CH4(g)+2NO2(g)?N2(g)+CO2(g)+2H2O(g)△H=a kJ/mol在温度T1和T2时,分别将0.50molCH4和1.2molNO2充入体积为1L的密闭容器中,测得n(CH4)随时间变化数据如下表:
| 温度 | 时间/min n/mol | 0 | 10 | 20 | 40 | 50 |
| T1 | n(CH4) | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
| T2 | n(CH4) | 0.50 | 0.30 | 0.18 | … | 0.15 |
| A. | 10 min内,T1时υ(CO2)比T2时小 | B. | 温度:T1>T2 | ||
| C. | a<0 | D. | 平衡常数:K(T1)<K(T2) |
分析 A.由表格中的数据结合v=$\frac{△c}{△t}$来计算υ(CH4);
B.温度升高,反应速率加快;
C.温度升高,甲烷剩余量增多,说明反应向左进行,正反应放热;
D.反应进行的越彻底,则平衡常数越大.
解答 解:A.10 min内,T1时υ(CH4)=$\frac{\frac{0.15mol}{1L}}{10min}$=0.015mol•L-1•min-1,T2时时υ(CH4)=$\frac{\frac{0.2mol}{1L}}{10min}$=0.02mol•L-1•min-1,T1时υ(CH4)比T2时小,故A正确;
B.温度升高,反应速率加快,因此T2>T1,故B错误;
C.温度升高,甲烷剩余量增多,说明反应向左进行,正反应放热,所以a<0,故C正确;
D.T1时反应进行的更为彻底,因此平衡常数更大,K(T1)>K(T2),故D错误;
故选:BD.
点评 本题主要考查外界条件对化学反应速率以及平衡移动原理及其应用,难度中等以上,注意灵活运用所学知识.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
7.下列有关溶液中粒子浓度的关系式中,不正确的是( )
| A. | pH相同的①CH3COONa、②NaHCO3、③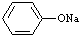 三份溶液中的c(Na+):③>②>① 三份溶液中的c(Na+):③>②>① | |
| B. | 0.1mol•L-1某二元弱酸强碱盐NaHA溶液中:c(Na+)=2c(A2-)+c(HA-)+c(H2A) | |
| C. | Na2CO3和NaHCO3溶液中:c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-) | |
| D. | 等物质的量的一元弱酸HX与其钾盐KX的混合溶液中:2c(K+)=c(X-)+c(HX) |
8.酸性锌锰干电池是一种一次电池,外壳为金属锌,中间是碳棒,其周围是碳粉,MnO2,ZnCl2和NH4Cl等组成的糊状填充物,该电池在放电过程产生MnOOH,回收处理该废电池可得到多种化工原料,有关数据下表所示:
溶解度/(g/100g水)
回答下列问题:
(1)该电池的正极反应式为MnO2+H++e-=MnOOH
(2)维持电流强度为0.5A,电池工作五分钟,理论上消耗Zn0.05g.(已经F=96500C/mol)
(3)废电池糊状填充物加水处理后,过滤,滤液中主要有ZnCl2和NH4Cl,二者可通过加热浓缩、冷却结晶分离回收;滤渣的主要成分是MnO2、C粉和MnOOH,欲从中得到较纯的MnO2,最简便的方法是空气中加热.
(4)用废电池的锌皮制备ZnSO4•7H2O的过程中,需去除少量杂质铁,其方法是:加稀硫酸和H2O2溶解,铁变为Fe3+,加碱调节至pH为2.7时,铁刚好完全沉淀(离子浓度小于1×10-5mol/L时,即可认为该离子沉淀完全);继续加碱调节至pH为6时,锌开始沉淀(假定Zn2+QUOTE浓度为0.1mol/L).
溶解度/(g/100g水)
温度/℃ 化合物 | 0 | 20 | 40 | 60 | 80 | 100 |
| NH4Cl | 29.3 | 37.2 | 45.8 | 55.3 | 65.6 | 77.3 |
| ZnCl2 | 343 | 395 | 452 | 488 | 541 | 614 |
| 化合物 | Zn(OH)2 | Fe(OH)2 | Fe(OH)3 |
| Ksp近似值 | 10-17 | 10-17 | 10-39 |
(1)该电池的正极反应式为MnO2+H++e-=MnOOH
(2)维持电流强度为0.5A,电池工作五分钟,理论上消耗Zn0.05g.(已经F=96500C/mol)
(3)废电池糊状填充物加水处理后,过滤,滤液中主要有ZnCl2和NH4Cl,二者可通过加热浓缩、冷却结晶分离回收;滤渣的主要成分是MnO2、C粉和MnOOH,欲从中得到较纯的MnO2,最简便的方法是空气中加热.
(4)用废电池的锌皮制备ZnSO4•7H2O的过程中,需去除少量杂质铁,其方法是:加稀硫酸和H2O2溶解,铁变为Fe3+,加碱调节至pH为2.7时,铁刚好完全沉淀(离子浓度小于1×10-5mol/L时,即可认为该离子沉淀完全);继续加碱调节至pH为6时,锌开始沉淀(假定Zn2+QUOTE浓度为0.1mol/L).
5.化学与人类生活密切相关,下列与化学相关的说法正确的是( )
| A. | 制饭勺、饭盒、高压锅等的不锈钢是合金 | |
| B. | 煎炸食物的花生油和牛油的营养价值一样高 | |
| C. | 做衣服的棉和麻中的纤维素与淀粉互为同分异构体 | |
| D. | 磨豆浆的大豆富含蛋白质,豆浆煮沸后蛋白质变成了氨基酸 |
2.用通式为“XYn”表示不同卤素之间靠共用电子对形成的卤素互化物 (已知非金属性:X<Y),其化学性质和卤素单质相似.则下列说法中正确的是( )
| A. | ICl与水反应可生成 HCl 和 HIO,则1mol ICI 参加反应转移电子为 1mol | |
| B. | 某温度下液态IF5发生电离:2IF5?IF4++IF6-,一定有c (IF4+)×c (IF6-)=c (IF5) | |
| C. | BrCl与Mg反应生成MgCl2和MgBr2 | |
| D. | XYn与卤素单质一样都是非极性分子 |
6.下列实验设计能够成功的是( )
| A. | 检验亚硫酸钠试样是否变质:试样$\stackrel{溶解}{→}$$\stackrel{滴加硝酸钡溶液}{→}$白色沉淀$\stackrel{滴加稀盐酸}{→}$沉淀不溶解→说明试样已变质 | |
| B. | 除去粗盐中含有的硫酸钙杂质:粗盐$\stackrel{溶解}{→}$$\stackrel{足量碳酸钠溶液}{→}$$\stackrel{足量氯化钡溶液}{→}$$\stackrel{过滤}{→}$$\stackrel{滤液中滴加盐酸}{→}$$\stackrel{蒸发结晶}{→}$精盐 | |
| C. | 检验某溶液中是否含有Fe2+:试样$\stackrel{滴加硫氰化钾溶液}{→}$溶液颜色无变化$\stackrel{滴加氯气}{→}$溶液变红色→溶液中含有Fe2+ | |
| D. | 证明酸性条件H2O2的氧化性比I2强:NaI溶液$\stackrel{30%过氧化氢、稀硝酸}{→}$$\stackrel{淀粉}{→}$溶液变紫色→氧化性:H2O2>I2 |
1.化学与生产,生活息息相关,下叙述错误的是( )
| A. | 大量化石燃料的燃烧是造成雾霾天气的一种重要因素 | |
| B. | 含重金属离子的电镀液不能随意排放 | |
| C. | 煤经过汽化和液化两个物理变化过程后变为清洁能源,这是煤的综合利用的方法 | |
| D. | 改进汽车尾气净化技术,减少大气污染物的排放 |

 对含氮物质的研究和利用有着极为重要的意义.
对含氮物质的研究和利用有着极为重要的意义.