题目内容
(1)铜粉放入稀H2SO4中,加热后无明显现象,当加入KNO3 后,铜粉质量减小,溶液变蓝,同时气体逸出,该反应的离子方程式为 。(2)在含Cu+的酶的活化中心内,亚硝酸根离子(NO2-)可转化为NO,写出Cu+与亚硝酸根离子在酸性水溶液中反应的离子方程式 。
方程式、离子方程式评分标准:
1.未配平或配平错误不得分;
2.配平正确,其它不全,扣1分 (如条件不全,缺“↑”等):
(6分)(1)3Cu+8H++2NO3-=3Cu2++4H2O+2NO↑(3分)
(2)Cu++2H++NO2-=Cu2++H2O+NO↑(3分)
解析试题分析:(1)铜是不活泼的金属,与稀硫酸不反应。由于在酸性条件下NO3-具有强氧化性,能和铜发生氧化还原反应生成硝酸铜、和水,反应的离子方程式为3Cu+8H++2NO3-=3Cu2++4H2O+2NO↑。
(2)在含Cu+的酶的活化中心内,亚硝酸根离子(NO2-)可转化为NO,这说明反应中NO2-得到电子,做氧化剂,因此Cu+失去电子,被氧化生成Cu2+,所以反应的离子方程式为Cu++2H++NO2-=Cu2++H2O+NO↑。
考点:考查硝酸、亚硝酸的氧化性以及与铜反应方程式的书写

下列反应离子方程式正确的是
| A.过量石灰水与碳酸氢钙反应:Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+2H2O |
| B.FeSO4酸性溶液暴露在空气中:4Fe2++O2+4H+=4Fe3++2H2O |
| C.向氯化铝溶液中滴加过量氨水:Al3++4NH3·H2O=AlO2-+4NH4++2H2O |
| D.H2SO4与Ba(OH)2溶液反应:Ba2++OH-+H++SO42-=BaSO4↓+H2O |
下列物质中,属于强电解质的是
| A.Cl2 | B.NaOH | C.NH3 | D.CH3COOH |
常温下,下列各组离子一定能大量共存的是( )
| A.滴加甲基橙试剂显红色的溶液中:Na+、Fe2+、Cl-、NO3- |
| B.C(H+)=10-12 mol·L-1的溶液:K+、Ba2+、Cl-、Br- |
| C.CO32-可以大量共存的溶液:Na+、K+、NO3-、Al3+ |
| D.由水电离的c(H+)=1.0×10-13 mol·L-1的溶液中:K+、NH4+、AlO2-、HCO3- |
某溶液中有①NH4+、②Mg2+、③Fe2+、④Al3+四种离子,若向其中加入过量的氢氧化钠溶液,微热并搅拌,再加入过量盐酸,溶液中大量减少的阳离子是
| A.①② | B.①③ | C.②③ | D.③④ |
下列相对应的方程式正确的是( )
| A.向NaHSO4溶液中滴加过量Ba(OH)2溶液:2H++SO42-+Ba2++2OH- = BaSO4↓+2H2O |
| B.氢氟酸雕刻玻璃:Si+4HF=SiF4↑+2H2↑ |
| C.向NaAlO2溶液中通入过量CO2:2AlO2-+CO2+3H2O = 2Al(OH)3↓+CO32- |
| D.用碳酸钠溶液吸收少量二氧化硫:2CO32-+SO2+H2O = 2HCO3-+SO32- |
常温,相应条件下,下列各组离子一定能大量共存的是
| A.c(Al3+)=0.1mol/L的溶液中:Na+、K+、AlO2-、OH- |
| B.无色溶液中:K+、CH3COO-、HCO3-、MnO4- |
C.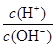 =1×1014的溶液:Ba2+、Na+、SO32-、NO3- =1×1014的溶液:Ba2+、Na+、SO32-、NO3- |
| D.通入足量CO2后所含离子还能大量共存的是:K+、Ca2+、NO3-、Cl- |
下列离子方程式书写不正确的是( )
| A.向100mL 1 mol/L溴化亚铁溶液中通入标准状况下的2.24L氯气:2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl- |
| B.硫酸亚铁溶液与稀硫酸、双氧水混合:Fe2++H2O2+2H+=Fe3++2H2O |
| C.碳酸钙溶于硝酸:CaCO3+2H+=Ca2++CO2↑+H2O |
| D.碳酸氢钠溶液与少量石灰水反应:2HCO3-+Ca2++2OH-=CaCO3↓+CO32-+2H2O |
 、
、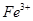 、
、 、
、 、
、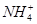 等阳离子。某同学进行如下实验:
等阳离子。某同学进行如下实验: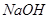 溶液至溶液呈碱性,加热,可产生使湿润的红色石蕊试纸变蓝色的气体。
溶液至溶液呈碱性,加热,可产生使湿润的红色石蕊试纸变蓝色的气体。