题目内容
下列物质中,属于强电解质的是
| A.Cl2 | B.NaOH | C.NH3 | D.CH3COOH |
B
解析试题分析:在溶液中完全电离出离子的电解质是强电解质,在溶液中部分电离,存在电离平衡的电解质是弱电解质。A、氯气是单质,不是电解质,也不是非电解质,A不正确;B、氢氧化钠在溶液中完全电离出阴阳离子,是强电解质,B正确;C、氨气不能发生自身的电离,是非电解质,C不正确;D、醋酸在溶液中发生部分电离,存在电离平衡,是弱电解质,D不正确,答案选B。
考点:考查电解质的有关判断

练习册系列答案
 天天练口算系列答案
天天练口算系列答案
相关题目
溶液中由水电离产生的c(OH—)=1×10—12mol/L,满足此条件的溶液中一定能大量共存的离子组是
| A.Fe2+ Na+ NO3— Cl— | B.K+Na+ Cl—AlO2— |
| C.K+ Ba2+ Cl— NO3— | D.K+ NH4+ SO42— CO32— |
下列表示对应化学反应的离子方程式正确的是
| A.NO2通入水中:3NO2+H2O=2H++2NO—3+NO |
B.用两个铜电极电解CuSO4溶液: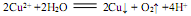 |
| C.SO2通入FeCl3溶液中:SO2+Fe3++2H2O=SO2—4+Fe2++4H+ |
D.过量的CO2通入NaAlO2溶液中: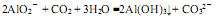 |
下列离子方程式书写正确的是
| A.Cu(OH)2中加入硫酸:OH-+H+ =H2O |
| B.钠加入水中:Na +2H2O=Na++2OH-+H2↑ |
| C.FeSO4溶液中加入稀硝酸:3Fe2++4H++NO3-=3Fe3++2H2O+NO↑ |
| D.Al2(SO4)3溶液中加入足量Ba(OH)2溶液:2Al3++3SO42-+ 3Ba2++6OH- =2Al(OH)3↓+3BaSO4↓ |
某无色溶液中只可能含有①Na+、②Ba2+、③Cl一、④Br一、⑤SO32一、⑥SO42一离子中的若干种(忽略水电离出的H+、OH一),依次进行下列实验,且每步所加试剂均过量,观察到的现象如下:
| 步骤 | 操作 | 现象 |
| (1) | 用pH试纸检验 | 溶液的pH大于7 |
| (2) | 向溶液中滴加氯水,再加入CCl4振荡,静置 | CCl4层呈橙色 |
| (3) | 向所得水溶液中加入Ba(NO3)2溶液和稀HNO3 | 有白色沉淀产生 |
| (4) | 过滤,向滤液中加入AgNO3溶液和稀HNO3 | 有白色沉淀产生 |
A.肯定含有的离子是③④⑤ B.肯定没有的离子是②⑤
C.可能含有的离子是①⑥ D.不能确定的离子是③⑥
下列离子方程式正确的是
| A.把少量SO2通入Ca(ClO)2溶液中:SO2+H2O+Ca2++2ClO-= 2HClO+CaSO3↓ |
| B.足量铁屑溶于稀硫酸:2Fe+6H+=2Fe3++3H2↑ |
| C.碳酸氢钙溶液中加入足量烧碱溶液:HCO3-+OH-=CO32-+H2O |
| D.铝片溶于烧碱溶液:2Al+2OH-+2H2O=2AlO2-+3H2↑ |
下列离子或分子组中能大量共存,且满足相应要求的是
| 选项 | 离子或分子 | 要求 |
| A | K+、NO3-、Cl-、HS- | c(K+) > c(Cl-) |
| B | Fe3+、MnO4?、SO32-、Cl- | 滴加盐酸立即有气体产生 |
| C | NH4+、Al3+、SO42-、CH3COOH | 滴加NaOH溶液立即有气体产生 |
| D | Na+、HCO3-、Ca2+、I- | 通CO2气体有沉淀产生 |
能正确表示下列反应的离子方程式是 ( )
| A.Fe3O4溶于足量稀HNO3:Fe3O4+8H+==Fe2++2Fe3++4H2O |
| B.NH4HCO3溶液与足量Ba(OH)2溶液混合:HCO3-+Ba2++OH-==BaCO3↓+H2O |
| C.向澄清石灰水中通入少量CO2:OH-+CO2==HCO3- |
| D.将0.2 mol·L-1的NH4Al(SO4)2溶液与0.3 mol·L-1的Ba(OH)2溶液等体积混合: |