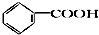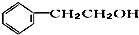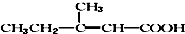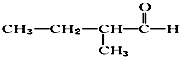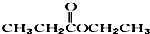题目内容
20.将一定量的BaSO4放入水中,对此有关的叙述正确的是( )| A. | BaSO4不溶于水,所以BaSO4固体质量不会减少 | |
| B. | BaSO4的电离方程式为:BaSO4?Ba2++SO42- | |
| C. | 加水或加入Na2SO4溶液,Ksp不变,沉淀溶解平衡不移动 | |
| D. | 体系中存在平衡:BaSO4(s)?Ba2+(aq)+SO42-(aq) |
分析 硫酸钡为难溶电解质,在水中存在溶解平衡,加水、硫酸钠可使溶解平衡发生移动,但Ksp只与温度有关,以此来解答.
解答 解:A.BaSO4不溶于水,是相对的,在水中存在溶解平衡,BaSO4固体质量会减少,故A错误;
B.为强电解质,BaSO4的电离方程式为BaSO4═Ba2++SO42-,故B错误;
C.加水或加入Na2SO4溶液,平衡移动,温度不变,则Ksp不变,故C错误;
D.难溶电解质存在溶解平衡,体系中存在平衡:BaSO4(s)?Ba2+(aq)+SO42-(aq),故D正确;
故选D.
点评 本题考查难溶电解质的溶解平衡,为高频考点,把握溶解平衡移动及溶解性等为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
相关题目
15.下列溶液一定呈中性的是( )
| A. | c(OH-)=$\sqrt{Kw}$的溶液 | B. | pH=7 的溶液 | ||
| C. | c(H+)=10-14的溶液 | D. | 加酚酞显无色的溶液 |
5.如图A、B、C、D、E、F为几种常见仪器的部分结构(有的仪器被放大)

(1)A图中液面所示溶液的体积为28.0mL,C图中的液面与“0”刻度之间的体积差为21.00mL;
(2)仪器E的名称是酸式滴定管;
(3)Na2S2O3(硫代硫酸钠),俗称大苏打.把Na2S2O3•5H2O固体溶于水,得到无色溶液,该溶液显碱性,用离子反应方程式解释溶液显碱性的原因:S2O32?+5H2O?HS2O3?+0H?.化工生产中常常依据反应2S2O32-+I2═S4O62-+2I-,用I2的标准溶液测定大苏打产品的纯度.步骤如下:
①称取5.5g Na2S2O3•5H2O产品,用仪器B(从上述A、B、C、D、E、F中选填)配制成100.00mL溶液;
②用仪器F(从上述A、B、C、D、E、F中选填)量取10.00mL溶液于锥形瓶中,以淀粉溶液为指示剂;
③用浓度为0.0500mol/L的I2标准溶液进行滴定,判断达到滴定终点的现象是锥形瓶中的溶液由无色变成蓝色且30秒内不恢复原色;
④重复滴定3次,数据记录于下表.计算所配制的Na2S2O3溶液的物质的量浓度为(保留4位小数)0.2000mol/L,Na2S2O3•5H2O在产品中的质量百分数是(保留1位小数)90.2%;
⑤滴定时若用Na2S2O3溶液润洗锥形瓶,则测得大苏打产品的纯度偏高(填偏高、偏低、不变.下同);若盛放I2标准液的滴定管下端有气泡,且在滴定过程中排出,则测得大苏打产品的纯度偏高.

(1)A图中液面所示溶液的体积为28.0mL,C图中的液面与“0”刻度之间的体积差为21.00mL;
(2)仪器E的名称是酸式滴定管;
(3)Na2S2O3(硫代硫酸钠),俗称大苏打.把Na2S2O3•5H2O固体溶于水,得到无色溶液,该溶液显碱性,用离子反应方程式解释溶液显碱性的原因:S2O32?+5H2O?HS2O3?+0H?.化工生产中常常依据反应2S2O32-+I2═S4O62-+2I-,用I2的标准溶液测定大苏打产品的纯度.步骤如下:
①称取5.5g Na2S2O3•5H2O产品,用仪器B(从上述A、B、C、D、E、F中选填)配制成100.00mL溶液;
②用仪器F(从上述A、B、C、D、E、F中选填)量取10.00mL溶液于锥形瓶中,以淀粉溶液为指示剂;
③用浓度为0.0500mol/L的I2标准溶液进行滴定,判断达到滴定终点的现象是锥形瓶中的溶液由无色变成蓝色且30秒内不恢复原色;
④重复滴定3次,数据记录于下表.计算所配制的Na2S2O3溶液的物质的量浓度为(保留4位小数)0.2000mol/L,Na2S2O3•5H2O在产品中的质量百分数是(保留1位小数)90.2%;
| 编号 | 1 | 2 | 3 | 4 |
| Na2S2O3溶液的体积/mL | 10.00 | 10.00 | 10.00 | 10.00 |
| 消耗I2标准溶液的体积/mL | 19.99 | 19.98 | 20.01 | 20.02 |
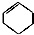
12.食品香精菠萝酯的生产路线(反应条件略去)如图,下列叙述错误的是( )


| A. | 步骤(1)产物中残留的苯酚可用FeCl3溶液检验 | |
| B. | 反应(1)和(2)均为取代反应 | |
| C. | 苯酚、苯氧乙酸和菠萝酯均可与NaOH溶液发生反应,均有酸性 | |
| D. | 与苯氧乙酸互为同分异构体,能使FeCl3溶液显紫色,并能发生水解反应但不发生银镜反应的芬香族化合物共有6种 |
9.下列说法中正确的是( )
| A. | 勒夏特列原理不能用于判断反应是否达平衡状态 | |
| B. | 浓度、压强、催化剂、温度等均能改变活化分子的百分数 | |
| C. | 能自发进行的反应其速率都很大 | |
| D. | 已知2C(s)+2O2(g)=2CO2(g)△H1,2C(s)+O2(g)=2CO(g)△H2,则△H1>△H2 |