题目内容
15.下列溶液一定呈中性的是( )| A. | c(OH-)=$\sqrt{Kw}$的溶液 | B. | pH=7 的溶液 | ||
| C. | c(H+)=10-14的溶液 | D. | 加酚酞显无色的溶液 |
分析 溶液的酸碱性是根据溶液中氢离子浓度和氢氧根离子浓度的相对大小判断的,当溶液中氢离子浓度大于氢氧根离子浓度时,溶液呈酸性;当氢离子浓度和氢氧根离子浓度相等时,溶液呈中性;当溶液中氢氧根离子浓度大于氢离子浓度时,溶液呈碱性,注意不能根据溶液的PH值大小判断.
解答 解:A、根据Kw=c(H+)•c(OH-),c(OH-)=$\sqrt{{K}_{W}}$的溶液则c(OH-)=c(H+),溶液一定呈中性,故A正确;
B、pH=7的溶液不一定呈中性,如100℃时,水的离子积常数是10-12,当PH=6时溶液呈中性,当pH=7时溶液呈碱性,故B错误;
C、c(H+)=10-14的溶液,pH=14,溶液是强碱性溶液,故C错误;
D、酚酞的变色范围:5-8,加酚酞显无色的溶液,可能呈弱碱性,不一定是中性溶液,故D错误;
故选A.
点评 本题考查了溶液酸碱性的判断,溶液的酸碱性是由溶液中H+浓度与OH-浓度的相对大小决定的,而不在于c(H+)或c(OH-)绝对值的大小.

练习册系列答案
相关题目
5.下列说法中不正确的是( )
①任何化学反应都伴有能量变化
②根据能量守恒定律,反应物的总能量等于生成物的总能量
③化石燃料在燃烧过程中能产生污染环境的CO、SO2等有害气体
④煤转化为煤气后燃烧,可以提高燃烧效率
⑤等质量的氢气燃烧生成水蒸气所放出的热量低于生成液态水所放出的热量
⑥等质量的硫蒸气和硫粉分别与氧气反应生成SO2气体,硫粉放出的热量多.
①任何化学反应都伴有能量变化
②根据能量守恒定律,反应物的总能量等于生成物的总能量
③化石燃料在燃烧过程中能产生污染环境的CO、SO2等有害气体
④煤转化为煤气后燃烧,可以提高燃烧效率
⑤等质量的氢气燃烧生成水蒸气所放出的热量低于生成液态水所放出的热量
⑥等质量的硫蒸气和硫粉分别与氧气反应生成SO2气体,硫粉放出的热量多.
| A. | ①③⑤ | B. | ①②③④⑤⑥ | C. | ②⑥ | D. | ②③④⑥ |
6.已知 X、Y、Z、Q、R、E六种元素中,原子序数X<Y<Z<Q<R<E,其结构或性质信息如下表.
请根据信息回答有关问题:
(1)元素Y的原子核外共有7种不同运动状态的电子,有3种不同能级的电子;
(2)X、Y、Z三种元素的电负性由高到低的排列次序依次为(写元素符号)O>N>C;
(3)X、Z、Q元素均表现最低化合价时的三种氢化物中,沸点由高到低的排列次序依次为(写化学式)H2O>HCl>CH4;
(4)R的最高化合价为+6.R的一种配合物的化学式为RCl3•6H2O.已知0.01molRCl3•6H2O在水溶液中用过量硝酸银溶液处理,产生0.02molAgCl沉淀.此配合物最可能是B;
A.[R(H2O)6]Cl3 B.[R(H2O)5Cl]Cl2•H2O
C.[R(H2O)4Cl2]Cl•2H2O D.[R(H2O)3Cl3]•3H2O
(5)元素E能形成八面体构型的配合物离子[E(YH3)xQ2]+,则中心离子为(写化学式)Co3+,配位体为(写化学式)NH3和Cl-,x的值为4;
(6)Y的最低价氢化物与Z的一种氢化物反应,生成的两种产物均不污染环境,其反应的化学方程式为2NH3+3H2O2═N2+6H2O.
| 元素 | 结构或性质信息 |
| X | 原子的L层上s电子数等于p电子数. |
| Y | 原子核外的L层有3个未成对电子. |
| Z | 在元素周期表的各元素中电负性仅小于氟. |
| Q | 单质常温、常压下是气体,原子的M层上有1个未成对的p电子. |
| R | 核电荷数是Y与Q的核电荷数之和 |
| E | 原子序数比R大3 |
(1)元素Y的原子核外共有7种不同运动状态的电子,有3种不同能级的电子;
(2)X、Y、Z三种元素的电负性由高到低的排列次序依次为(写元素符号)O>N>C;
(3)X、Z、Q元素均表现最低化合价时的三种氢化物中,沸点由高到低的排列次序依次为(写化学式)H2O>HCl>CH4;
(4)R的最高化合价为+6.R的一种配合物的化学式为RCl3•6H2O.已知0.01molRCl3•6H2O在水溶液中用过量硝酸银溶液处理,产生0.02molAgCl沉淀.此配合物最可能是B;
A.[R(H2O)6]Cl3 B.[R(H2O)5Cl]Cl2•H2O
C.[R(H2O)4Cl2]Cl•2H2O D.[R(H2O)3Cl3]•3H2O
(5)元素E能形成八面体构型的配合物离子[E(YH3)xQ2]+,则中心离子为(写化学式)Co3+,配位体为(写化学式)NH3和Cl-,x的值为4;
(6)Y的最低价氢化物与Z的一种氢化物反应,生成的两种产物均不污染环境,其反应的化学方程式为2NH3+3H2O2═N2+6H2O.
3.下列有关物质的俗名正确的是( )
| A. | Na2CO3→纯碱、小苏打 | B. | CuSO4→胆矾、蓝矾 | ||
| C. | KAl(SO4)2•12H2O→明矾 | D. | Fe3O4→铁红 |
20.将一定量的BaSO4放入水中,对此有关的叙述正确的是( )
| A. | BaSO4不溶于水,所以BaSO4固体质量不会减少 | |
| B. | BaSO4的电离方程式为:BaSO4?Ba2++SO42- | |
| C. | 加水或加入Na2SO4溶液,Ksp不变,沉淀溶解平衡不移动 | |
| D. | 体系中存在平衡:BaSO4(s)?Ba2+(aq)+SO42-(aq) |
7.茉莉花香气成分中含有茉莉酮,其香味浓郁,被广泛应用于化妆品的制造中,其结构简式为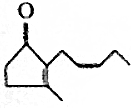 .
.
(1)一分子该有机物中的碳原子数为11,分子式为C11H16O.
(2)该有机物分子中含有的官能团有碳碳双键、羰基.
 .
.(1)一分子该有机物中的碳原子数为11,分子式为C11H16O.
(2)该有机物分子中含有的官能团有碳碳双键、羰基.
4.某同学从自家厨房找到一些被大量花生油污染的粗盐固体,此粗盐中还混有 Mg2+、Ca2+、SO42-等杂质,该同学欲将该粗盐提纯,得到纯净的氯化钠固体.请你帮助他从以下操作中选择正确操作和顺序 ( )
①过滤②加过量NaOH溶液;③加适量稀盐酸;④加过量Na2CO3溶液;⑤加过量BaCl2溶液;⑥静置分液;⑦蒸发结晶;⑧加适量水溶解.
①过滤②加过量NaOH溶液;③加适量稀盐酸;④加过量Na2CO3溶液;⑤加过量BaCl2溶液;⑥静置分液;⑦蒸发结晶;⑧加适量水溶解.
| A. | ②⑤④①③ | B. | ⑧④①②⑤③⑦ | C. | ⑧⑥②⑤④①③⑦ | D. | ⑧②④⑤①⑥③⑦ |
5.向含有下列离子的溶液中分别加入烧碱固体(溶液体积变化可忽略),离子浓度保持不变的应该是下列选项中的( )
| A. | OH- | B. | Na+ | C. | HCO3- | D. | Cl- |