题目内容
1.下列有关说法正确的是( )| A. | 氢氧燃料电池的能量转换形式仅为化学能转化为电能 | |
| B. | 一定条件下,使用催化剂能加快反应速率但不能改变平衡转化率 | |
| C. | NH4Cl和HCl溶于水后滴加石蕊都变红色,说明它们均能电离出H+ | |
| D. | 在一密闭容器中发生2SO2+O2?2SO3反应,增大压强,平衡会正向移动,$\frac{{c}^{2}(S{O}_{3})}{{c}^{2}(S{O}_{2})•c({O}_{2})}$的值增大 |
分析 A、燃料电池中能量转化形式主要是化学能转化为电能,同时伴随热能等;
B、催化剂改变反应速率不改变化学平衡;
C、铵根离子水解生成氢离子;
D、$\frac{{c}^{2}(S{O}_{3})}{{c}^{2}(S{O}_{2})•c({O}_{2})}$的值为平衡常数,平衡常数随温度变化.
解答 解:A、燃料电池中能量转化形式主要是化学能转化为电能,同时伴随热能等,故A错误;
B、催化剂改变反应速率不改变化学平衡,不能改变平衡转化率,故B正确;
C、铵根离子水解生成氢离子,溶液显酸性滴加石蕊变红色,故C错误;
D、$\frac{{c}^{2}(S{O}_{3})}{{c}^{2}(S{O}_{2})•c({O}_{2})}$的值为平衡常数,平衡常数随温度变化,增大压强不影响平衡常数,故D错误;
故选B.
点评 本题考查了化学平衡、化学反应速率影响因素,原电池能量变化,盐类水解对水电离的影响,掌握基础是关键,题目较简单.

练习册系列答案
相关题目
11.某溶液可能含有Al3+、NH4+、Fe2+、Na+、CO32-、SO42-、Cl-、NO3-中的若干种.若在该溶液中逐滴加入稀盐酸至过量无明显现象,并得到X溶液,对X溶液进行如下实验:(已知该题忽略水的电离,且原溶液中各离子浓度均为0.5mol•L-1).下列结论正确的是( )
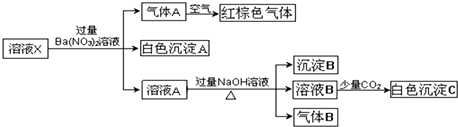

| A. | 原溶液中可能含有NO3-和Al3+ | |
| B. | 白色沉淀C可能是Al(OH)3 | |
| C. | 原溶液中一定存在NH4+、Fe2+、SO42-、Cl- | |
| D. | 沉淀B可能是Fe(OH)2和Fe(OH)3的混合物 |
12.化学在生产生活中有重要作用,下列说法正确的是( )
| A. | 碘有智力元素之称,所以应该大量服用补碘药片 | |
| B. | 汽车尾气中的氮氧化物是汽油不完全燃烧产生的 | |
| C. | 二氧化硫可用于食品防腐,但不能用于食品漂白 | |
| D. | “辽宁舰”上使用的特种钢缆属于新型无机非金属材料 |
16.下列有关电解质溶液中微粒的关系正确的是( )
| A. | 25℃时,pH=4的氯化铵溶液中:c(NH4+)>c(Cl-)>c(H+)>c(OH-) | |
| B. | 25℃时,pH=3的氯化铵溶液中:c(OH-)=1.0×10-3mol•L-1 | |
| C. | 将pH=5的醋酸溶液稀释后,恢复至原温度,pH和Kw均增大 | |
| D. | 向NH4HSO4溶液中加入等物质的量的NaOH形成的溶液中:c(Na+)=c(SO42-)>c(NH4+)>c(H+)>c(OH-) |
11.已知下列反应的反应热:
①CH3COOH(l)+2O2(g)═2CO2(g)+2H2O(l)△H1=-870.3kJ/mol
②C(s)+O2(g)═CO2(g)△H2=-393.5kJ/mol
③H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H3=-285.8kJ/mol
则2C(s)+2H2(g)+O2(g)═CH3COOH(l)的反应热为( )
①CH3COOH(l)+2O2(g)═2CO2(g)+2H2O(l)△H1=-870.3kJ/mol
②C(s)+O2(g)═CO2(g)△H2=-393.5kJ/mol
③H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H3=-285.8kJ/mol
则2C(s)+2H2(g)+O2(g)═CH3COOH(l)的反应热为( )
| A. | -870.3 kJ/mol | B. | -571.6 kJ/mol | C. | +787.0 kJ/mol | D. | -488.3 kJ/mol |
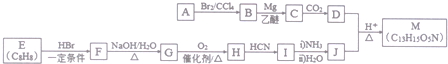
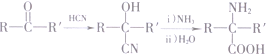 (R′表示氢原子或烃基)
(R′表示氢原子或烃基)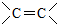 ,
,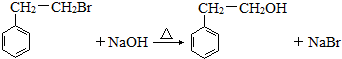 .
.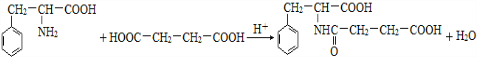 .
.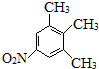 、
、 (不考虑立体异构).
(不考虑立体异构).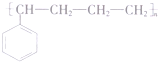 的合成路线流程图(无机试剂任用)合成路线流程图示例为:CH3CHO$→_{催化剂/△}^{O_{2}}$CH3COOH$→_{浓H_{2}SO_{4}/△}^{CH_{3}OH}$CH3COOCH3.
的合成路线流程图(无机试剂任用)合成路线流程图示例为:CH3CHO$→_{催化剂/△}^{O_{2}}$CH3COOH$→_{浓H_{2}SO_{4}/△}^{CH_{3}OH}$CH3COOCH3. .其合成路线如图.
.其合成路线如图.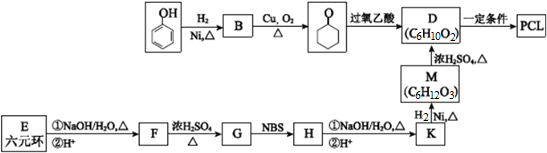
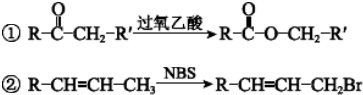
 .
. .
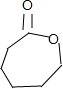
.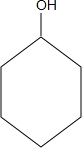 $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$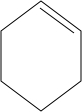 $→_{Zn/H_{2}O}^{O_{3}}$OHCCH2CH2CH2CH2CHO$\stackrel{O_{2}}{→}$HOOCCH2CH2CH2CH2COOH.
$→_{Zn/H_{2}O}^{O_{3}}$OHCCH2CH2CH2CH2CHO$\stackrel{O_{2}}{→}$HOOCCH2CH2CH2CH2COOH.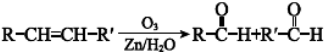
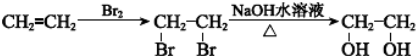
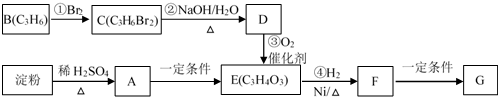
 .
.