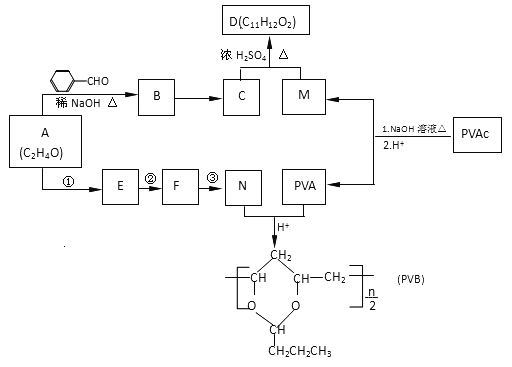
题目内容
【题目】I.以Zn和Cu为电极,稀H2SO4为电解质溶液形成的原电池,某实验兴趣小组做完实验后,在读书卡片上记录如下:
①Zn为正极,Cu为负极
②H+向负极移动
③Cu极有H2产生
④电子流动方向Zn→Cu
⑤正极的电极反应式是Zn-2e-=Zn2+
⑥若有1mol电子流过导线,则理论上产生0.5 mol H2
(1)卡片中记录合理的是___________(填序号)
(2)该电池总反应的离子方程式是___________________________
(3)若将稀硫酸换成硫酸铜溶液,电极质量增加的是_____________ (填“锌极”或“铜极”)
Ⅱ.某温度时,在2 L密闭容器中,三种气态物质X、 Y、Z的物质的量(n)随时间(t)变化的曲线如右图所示,可得:
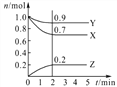
(1)该反应的化学方程式为_____________________
(2)反应开始至2 min,用Y表示的平均反应速率 为_______________
(3)在一定温度下,上述反应达到反应限度的标志的是____________
A. X、Y、Z的浓度相等
B. X、Y、Z的分子数比为3︰1︰2
C. Z的生成速率是Y的生成速率的二倍
D.单位时间内生成n mol Y,同时生成3n mol X
【答案】 ③④⑥ Zn+2H+=Zn2++H2↑ 铜极 3X+Y![]() 2Z 0.025mol/(L·min) C
2Z 0.025mol/(L·min) C
【解析】I.(1)锌比铜活泼,形成原电池反应时,锌为负极,发生氧化反应,电极方程式为Zn-2e-═Zn2+,铜为正极,发生还原反应,电极方程式为2H++2e-═H2↑,由此可知若有1mol电子流经导线,则产生0.5mol氢气,电子由负极经外电路流向正极,原电池中阳离子向正极移动,阴离子向负极移动,则正确的有③④⑥,故答案为:③④⑥;
(2)该电池总反应的离子方程式是Zn+2H+=Zn2++H2↑,故答案为:Zn+2H+=Zn2++H2↑;
(3)如果把硫酸换成硫酸铜溶液,正极Cu上会有铜单质析出,而变粗,其电极反应为:Cu2++2e-=Cu,故答案为:铜极;
Ⅱ.(1)由图象可以看出,反应中X、Y的物质的量减小,Z的物质的量增多,则X、Y为反应物,Z为生成物,且△n(X):△n(Y):△n(Z)=0.3mol:0.1mol:0.2mol=3:1:2,则反应的化学方程式为:3X+Y ![]() 2Z,故答案为:3X+Y
2Z,故答案为:3X+Y ![]() 2Z;
2Z;
(2)在2min时间内,用Y表示的平均反应速率为v(Y)= ![]() ×0.05mol/(Lmin)=0.025mol/(Lmin);故答案为: 0.025mol/(Lmin);
×0.05mol/(Lmin)=0.025mol/(Lmin);故答案为: 0.025mol/(Lmin);
(3)A. X、Y、Z的浓度相等,不能说明浓度不变,错误;B. X、Y、Z的分子数比为3︰1︰2,不能说明浓度不变,错误;C. Z的生成速率是Y的生成速率的二倍,说明正逆反应速率相等,说明反应达到反应限度,正确; D.单位时间内生成n mol Y,同时生成3n mol X,表示的都是逆反应速率,不能说明反应达到反应限度,错误;故选C。

【题目】某学习小组为探究MnO2与FeCl3·6H2O的反应,设计了下列装置:

查阅文献有如下信息:①FeCl3 熔点282℃,沸点315℃, 2FeCl3 ![]() 2FeCl2+Cl2↑
2FeCl2+Cl2↑
②FeCl6·6H2O 熔点37℃,沸点285℃
实验过程记录:
操作步骤 | 现象 |
1.检查装置气密性,添加相应药品, 点燃酒精灯,开始给试管A加热 | |
2.打开a,关闭b、c, 用湿润的蓝色石蕊试纸贴近a口 | A中出现白雾,蓝色石蕊试纸变红 |
3.打开b,关闭a、c | A中逐渐产生黄色气体,试管及导管壁内附有黄色液滴,B中溶液变红 |
4.打开c,关闭a、b | C中溶液变棕黄色 |
5.停止加热 |
回答下列问题:
(1)A中的白雾是________________________。
(2)管壁内形成黄色液滴,可能的原因是______________________。
(3)B中溶液变红,请用离子方程式解释其原因_______________________。
(4)对C中溶液变黄色,小组展开进一步实验:

Ⅰ.C中变黄的原因是___________________________________________。
Ⅱ.C中发生反应的离子方程式是________________________________。
(5)对A中残留物进行分离,其中得到一种不溶于水的红棕色固体,写出A中生成该固体的化学方程式____________________________________。
(6)在A中MnO2发生的化学反应为__________________________________。