题目内容
【题目】某校学生用中和滴定法测定某NaOH溶液的物质的量浓度,选甲基橙作指示剂。
(1)盛装0.2000 mol/L盐酸标准液应该用__式滴定管。
(2)滴定时,左手控制滴定管,右手摇动锥形瓶,眼睛注视__;终点判断方法:_________________
(3)滴定操作可分解为如下几步:
①检查滴定管是否漏水;
②取一定体积的待测液于锥形瓶中;
③用标准溶液润洗盛标准溶液的滴定管,用待测液润洗盛待测液的滴定管
④装标准溶液和待测液并调整液面(记录初读数)
⑤用蒸馏水洗涤玻璃仪器
⑥滴定操作
正确的操作顺序为:_____
(4)有关数据记录如下:
实验序号 | 待测液体积(mL) | 所消耗盐酸标准液的体积(mL) | |
滴定前 | 滴定后 | ||
1 | 20. 00 | 0.60 | 20.70 |
2 | 20.00 | 6.00 | 25.90 |
3 | 20.00 | 1.40 | 23.20 |
则NaOH溶液的物质的量浓度为______mol/L(保留四位有效数字)
(5)若滴定时锥形瓶未干燥,则测定结果________;若滴定前平视读数,滴定终点时仰视读数,则会使所测碱的浓度值________。(填“无影响”、“偏高”或“偏低”)。
【答案】酸 锥形瓶内溶液颜色的变化 黄色变成橙色,并且在半分钟内无颜色变化 ①⑤③④②⑥ 0.2000 无影响 偏高
【解析】
酸碱中和滴定实验原理:c(NaOH)×V(NaOH)=c(HCl)×V(HCl),代入实验数据(注意数据的有效性)计算c(NaOH);根据实验操作步骤进行滴定的排序,其中盐酸要用酸式滴定管进行量取,用甲基橙做指示剂,根据颜色的变化确定滴定终点。
(1) 滴定操作中,酸或者强氧化性物质要用酸式滴定管盛装,碱用碱式滴定管盛装,故盛装0.2000 mol/L盐酸标准液应该用酸式滴定管;
(2) 滴定时,眼睛要注视着锥形瓶内溶液颜色的变化,避免产生较大误差;由于用甲基橙作指示剂,甲基橙变色的pH范围为3.1~4.4,故终点判断方法:溶液由黄色变为橙色,并且在半分钟内无颜色变化;
(3) 滴定操作的正确顺序是:检漏、洗涤、润洗、装液、赶气泡、调节液面并记录初读数、取液、滴定,故答案为①⑤③④②⑥;
(4) 三次消耗的盐酸的体积分别为:20.10mL、19.90mL、21.80mL(误差太大,舍去);前两次平均体积为20.00mL,代入c(NaOH)=![]() ;
;
(5) 锥形瓶不干燥或是滴定过程中用蒸馏水冲洗锥形瓶内壁,都不会影响被滴定液中溶质的物质的量,即n值不变,所耗标准溶液的体积不变,则测定结果无影响;若滴定前平视读数,滴定终点时仰视读数,读数偏大,所耗标准溶液的体积偏大,则会使所测碱的浓度值偏高。

 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案【题目】利用如下实验探究铁钉在不同溶液中的吸氧腐蚀。下列说法不正确的是
实验装置 | 实验编号 | 浸泡液 | pH | 氧气浓度随时间的变化 |
|
|
| 5 |
|
|
| 5 | ||
|
| 7 | ||
|
| 7 |
A.上述正极反应均为![]()
B.在不同溶液中,![]() 是影响吸氧腐蚀速率的主要因素
是影响吸氧腐蚀速率的主要因素
C.向实验![]() 中加入少量
中加入少量![]() 固体,吸氧腐蚀速率加快
固体,吸氧腐蚀速率加快
D.![]() 内,铁钉的平均吸氧腐蚀速率酸性溶液大于中性溶液
内,铁钉的平均吸氧腐蚀速率酸性溶液大于中性溶液
【题目】25 ℃时,部分物质的电离平衡常数如表所示:
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 | 1.7×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
请回答下列问题:
(1)写出H2CO3电离方程式_________平衡常数表达式Ka1(H2CO3)=__________________
(2)CH3COOH、H2CO3、HClO的酸性由强到弱的顺序为___________
(3)①CH3COO-、②HCO3-、③CO32-、④ClO-结合H+的能力由强到弱的顺序为(注意:用序号①、②、③、④作答)____________________
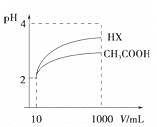
(4)体积为10mLpH=2的醋酸溶液与一元酸HX溶液分别加水稀释至1000mL,稀释过程pH变化如图:则HX的电离平衡常数__________(填“大于”、“等于”或“小于”)醋酸的平衡常数。
(5)将少量CO2气体通入NaClO溶液中,写出反应的离子方程式_____________