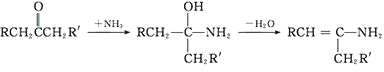
题目内容
【题目】下列说法不正确的是
A.25℃时将10mLpH=11的氨水加水稀释至100mL时氨水的浓度是0.01mol/L(氨水的Kb=1×10-5)
B.室温下向10mLpH=3的醋酸溶液中加水稀释,溶液中![]() 不变
不变
C.现有浓度均为0.1 mol·L-1的盐酸、硫酸、醋酸三种溶液,分别用以上三种酸溶液中和一定量的NaOH溶液,反应后溶液呈中性,需要酸溶液的体积分别为V1、V2、V3,其大小关系为V3> V1> V2
D.将等体积pH=4的盐酸和醋酸稀释到pH=5的溶液,盐酸所加的水量多,说明盐酸是强酸,醋酸是弱酸
【答案】D
【解析】
A. 25℃时,10mLpH=11的氨水中c(CH3COOH)=![]() =
=![]() =0.1mol/L,加水稀释至100mL时氨水的浓度是0.01mol/L,A正确;
=0.1mol/L,加水稀释至100mL时氨水的浓度是0.01mol/L,A正确;
B. 室温下向10mLpH=3的醋酸溶液中加水稀释,溶液中![]() =
=![]() ,Ka、Kw只受温度的影响,不受浓度变化的影响,B正确;
,Ka、Kw只受温度的影响,不受浓度变化的影响,B正确;
C. 浓度均为0.1 mol·L-1的盐酸、硫酸、醋酸,c(H+)分别为0.1mol/L、0.2mol/L、0.1mol/L,中和一定量的NaOH溶液,当溶液呈中性,可得0.1V1=0.2V2<0.1V3(醋酸钠溶液呈碱性,醋酸应过量),从而得出V3> V1> V2,C正确;
D. 将等体积pH=4的盐酸和醋酸稀释到pH=5的溶液,醋酸所加的水量多,说明醋酸加水稀释后,n(H+)增大,从而说明盐酸是强酸,醋酸是弱酸,D错误。
故选D。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】富硼渣中含有镁硼酸盐(2MgO·B2O3)、镁硅酸盐(2MgO·SiO2)及少量Al2O3、FeO等杂质。由富硼渣湿法制备硫酸镁晶体和硼酸(H3BO3)晶体的一种工艺流程如下:

已知:生成氢氧化物沉淀的pH(金属离子的起始浓度为0.1mol/L)
Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 | |
开始沉淀时 | 1.9 | 3.4 | 7.0 | 9.1 |
完全沉淀时 | 3.2 | 4.7 | 9.0 | 11.1 |
(1)上述流程中能加快反应速率的措施有______、_______等。
(2)酸浸时发生反应:2MgO·SiO2 + 2H2SO4=2MgSO4 + SiO2 + 2H2O,2MgO·B2O3+ 2H2SO4 + H2O=2H3BO3 + 2MgSO4。
①上述反应体现出酸性强弱:H2SO4______H3BO3(填“>”或“<”)。
② 酸浸时,富硼渣中所含Al2O3和FeO也同时溶解,写出相关反应的离子方程式:______、______。
③ 已知硼酸与过量NaOH溶液发生的中和反应为:H3BO3 + OH- B(OH)4-。下列关于硼酸的说法正确的是__(填序号)。
a. 硼酸是一元酸
b. 向NaHCO3固体中滴加饱和硼酸溶液,有气泡产生
c. 硼酸的电离方程式可表示为:H3BO3 + H2O![]() B(OH)4-+H+
B(OH)4-+H+
(3)检验褐色浸出液中的杂质离子:取少量浸出液,______(填操作和现象),证明溶液中含有Fe2+。
(4)除去浸出液中的杂质离子: 用MgO调节溶液的pH至______以上,使杂质离子转化为______(填化学式)沉淀,过滤。
(5)获取晶体:ⅰ.浓缩滤液,使MgSO4和H3BO3接近饱和;ⅱ.控制温度使两种晶体分别从溶液中结晶。结合下图溶解度曲线,简述ⅱ的方法:将浓缩液加入到高压釜中,______(将方法补充完整)。

【题目】某校学生用中和滴定法测定某NaOH溶液的物质的量浓度,选甲基橙作指示剂。
(1)盛装0.2000 mol/L盐酸标准液应该用__式滴定管。
(2)滴定时,左手控制滴定管,右手摇动锥形瓶,眼睛注视__;终点判断方法:_________________
(3)滴定操作可分解为如下几步:
①检查滴定管是否漏水;
②取一定体积的待测液于锥形瓶中;
③用标准溶液润洗盛标准溶液的滴定管,用待测液润洗盛待测液的滴定管
④装标准溶液和待测液并调整液面(记录初读数)
⑤用蒸馏水洗涤玻璃仪器
⑥滴定操作
正确的操作顺序为:_____
(4)有关数据记录如下:
实验序号 | 待测液体积(mL) | 所消耗盐酸标准液的体积(mL) | |
滴定前 | 滴定后 | ||
1 | 20. 00 | 0.60 | 20.70 |
2 | 20.00 | 6.00 | 25.90 |
3 | 20.00 | 1.40 | 23.20 |
则NaOH溶液的物质的量浓度为______mol/L(保留四位有效数字)
(5)若滴定时锥形瓶未干燥,则测定结果________;若滴定前平视读数,滴定终点时仰视读数,则会使所测碱的浓度值________。(填“无影响”、“偏高”或“偏低”)。