��Ŀ����
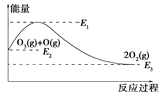
����Ŀ��ij�¶��£���2molSO2��1molO2����10L�ܱ������з�����Ӧ��2SO2(g)��O2(g) ![]() 2SO3(g)����H<0��SO2��ƽ��ת����(��)����ϵ��ѹǿ(p)�Ĺ�ϵ��ͼ����ʾ��������˵����ȷ������ ��
2SO3(g)����H<0��SO2��ƽ��ת����(��)����ϵ��ѹǿ(p)�Ĺ�ϵ��ͼ����ʾ��������˵����ȷ������ ��

A. ��ͼ���ƶϣ�B��SO2��ƽ��Ũ��Ϊ0.3 mol��L-1
B. ��ͼ���ƶϣ�A���Ӧ�¶��¸÷�Ӧ��ƽ�ⳣ��Ϊ800(L��mol-1)
C. ��ƽ��������������ݻ�����Ӧ���ʱ仯ͼ�������ͼ�ұ�ʾ
D. ѹǿΪ0.50 MPaʱ��ͬ�¶���SO2ת�������¶ȹ�ϵ���ͼ����T2>T1
���𰸡�B
�����������������A������������ʼŨ��Ϊ2mol/10L=0.2mol/L���ɼ�ͼ��֪B��SO2��ת����Ϊ0.85��������c(SO2)=0.85��0.2mol/L=0.17mol/L���ʶ��������ƽ��Ũ��Ϊ0.2mol/L-0.17mol/L=0.03mol/L����A����B���ɼ�ͼ��֪A��SO2��ת����Ϊ0.8��������c(SO2)=0.8��0.2mol/L=0.16mol/L����
2SO2(g)+O2(g)![]() 2SO3(g)
2SO3(g)
��ʼ(mol/L)��0.2 0.1 0
�仯(mol/L)��0.16 0.08 0.16
ƽ��(mol/L)��0.04 0.02 0.16
����A��ƽ�ⳣ��ΪK=![]() =800����B��ȷ��C����ƽ�����С�����ݻ�����Ӧ������Ũ�ȶ����������淴Ӧ���ʶ�������ϵѹǿ����ƽ���������С�ķ�Ӧ�ƶ�����ƽ��������Ӧ�ƶ�����V(��)��V(��)��������ͼ�ұ�ʾ����C����D���ɵ���ƽ���ʱ���֪���¶�ΪT1���ȵ���ƽ�⣬��Ӧ���ʿ죬�¶�Խ�߷�Ӧ����Խ�죬��T2��T1����D����
=800����B��ȷ��C����ƽ�����С�����ݻ�����Ӧ������Ũ�ȶ����������淴Ӧ���ʶ�������ϵѹǿ����ƽ���������С�ķ�Ӧ�ƶ�����ƽ��������Ӧ�ƶ�����V(��)��V(��)��������ͼ�ұ�ʾ����C����D���ɵ���ƽ���ʱ���֪���¶�ΪT1���ȵ���ƽ�⣬��Ӧ���ʿ죬�¶�Խ�߷�Ӧ����Խ�죬��T2��T1����D����
��ѡD��