题目内容
20.将1.68g铁粉投入100mL稀硝酸中,两物质恰好完全反应,硝酸的还原产物全部是NO.向反应后的溶液中加入一定量的NaOH溶液,恰好使铁元素完全转化为沉淀,过滤,将滤渣放置较长时间后洗涤、干燥、灼烧、称重,得固体ag.(1)a的值是2.4.
(2)此硝酸的物质的量浓度范围是0.8 mol/L≤C(HNO3)≤1.2 mol/L
(3)假如反应中放出NO的体积(标况下)为582.4mL,若向铁与硝酸反应后的溶液中继续加入铁屑,该溶液还能溶解的铁的质量为0.504g;
(4)若用氢氧化钠饱和溶液去沉淀铁与硝酸反应后溶液中的全部铁元素,至少需要取该氢氧化钠饱和溶液4mL.(已知:25℃时,氢氧化钠的溶解度为118g,氢氧化钠饱和溶液的密度为1.44g/cm3)
分析 (1)铁与稀硝酸反应生成的不管是二价的铁还是三价的铁,再与氢氧化钠溶液反应并放置较长时间后洗涤、干燥、灼烧、称重,得固体为氧化铁;
(2)完全生成硝酸铁时消耗的硝酸最多,完全生成硝酸亚铁时消耗的硝酸最少;
(3)根据生成硝酸亚铁时转移的电子数计算生成582.4mLNO时还能转移多少电子即可解答;
(4)根据w=$\frac{s}{100+s}$计算氢氧化钠的溶液质量分数,根据c=$\frac{1000ρω}{M}$计算氢氧化钠溶液物质的量浓度
解答 解:(1)铁与稀硝酸反应生成的不管是二价的铁还是三价的铁,再与氢氧化钠溶液反应并放置较长时间后洗涤、干燥、灼烧、称重,得固体为氧化铁,根据铁元素守恒,生成的氧化铁质量m=$\frac{1.68g}{56g/mol}$=0.03mol,所以氧化铁的物质的量为:0.015mol,质量为:0.015mol×160g/mol=2.4g,故答案为:2.4;
(2)1.68g铁粉物质的量n=$\frac{1.68g}{56g/mol}$=0.03mol,完全生成硝酸铁时消耗的硝酸最多,假设生成的NO为xmol,根据得失电子守恒,0.03×3=(5-2)x,解得x=0.03,则消耗的硝酸为0.03×3+0.03=0.12mol,硝酸浓度为$\frac{0.12mol}{0.1L}$=1.2mol/L,
完全生成硝酸亚铁时消耗的硝酸最少,假设生成的NOymol,根据得失电子守恒,0.03×2=(5-2)y,解得y=0.02,则消耗的硝酸为0.03×2+0.02=0.08mol,硝酸浓度为$\frac{0.08mol}{0.1L}$=0.8mol/L,
故硝酸的物质的量浓度范围是0.8 mol/L≤C(HNO3)≤1.2 mol/L,故答案为:0.8 mol/L≤C(HNO3)≤1.2 mol/L;
(3)1.68g铁粉完全生成硝酸亚铁时消耗的铁最多,转移的电子数为$\frac{1.68g}{56g/mol}$=0.06mol,反应中放出NO的体积(标况下)为582.4mL时转移的电子数为$\frac{0.5824L}{22.4L/mol}$=0.078mol,此时还能消耗铁的质量为(0.078-0.06)mol×$\frac{1}{2}$=0.504g,故答案为:0.504.
(4)w=$\frac{s}{100+s}$=$\frac{118}{118+100}×100%$=54%,所以c=$\frac{1000ρω}{M}$=$\frac{1000×1.44×54%}{40}$=19.44mol/L,如果铁恰好变成亚铁,此时消耗氢氧化钠的物质的量最少,即V=$\frac{0.03×2}{19.44}$=0.0038L=4.0mL,答:至少需要取该氢氧化钠饱和溶液4mL.
点评 本题考查了铁与稀硝酸反应的量的关系问题,根据得失电子守恒可以简单的解答此类问题,难度中等.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | C3H8 | B. | C4H10 | C. | CHCl3 | D. | CH2Cl2 |
| A. | 乙烯的结构简式CH2CH2 | B. | Na2O2中氧元素的化合价为-2 | ||
| C. | Cl-的结构示意图: | D. | 乙酸的最简式:CH2O |
| A. | 化学反应达到化学平衡状态的正逆反应速率相等,是指同一物质的消耗速率和生成速率相等,若用不同物质表示时,反应速率不一定相等 | |
| B. | 标准状况下,1L辛烷完全燃烧生成CO28L | |
| C. | 2.4gMg无论与O2还是与N2完全反应,转移电子数都是0.2NA | |
| D. | 1L 1mol•L-1 CH3COOH溶液中,所含CH3COO-、CH3COOH的总数为NA |
| A. | 甲烷是天然气的主要成分 | B. | 乙烯能使溴的四氯化碳溶液褪色 | ||
| C. | 苯分子中含有3个C=C键 | D. | 甲苯能使高锰酸钾溶液褪色 |
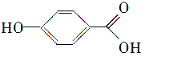
| A. | 苯 | B. | 苯酚 | C. | 乙酸 | D. | 甲醛 |
 .
. .
. .
.