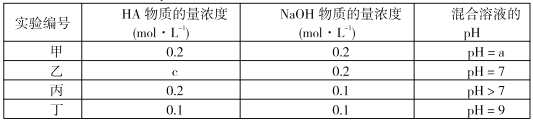
题目内容
【题目】用铅蓄电池电解AgNO3、Na2SO3的溶液,a、b、c、d电极材料均为石墨,已知铅蓄电池的总反应为:Pb(s)+PbO2(s)+2H2SO4(aq)![]() 2PbSO4(s)+2H2O(1)通电时a电极质量增加,下列说法正确的是
2PbSO4(s)+2H2O(1)通电时a电极质量增加,下列说法正确的是
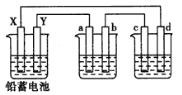
A.电路中通过1mol电子时,Y电极质量增加48g
B.放电时铅蓄电池负极的电极反应式为:PbO2(s)+4H+(aq)+SO42-(aq)+2e-===PbSO4(s)+2H2O(l)
C.c、d电极产生气体的物质的量之比为1∶2
D.X极为负极
【答案】A
【解析】
试题分析:A、Y电极是负极,铅放电生成硫酸铅,电路中通过1mol电子时,增加0.5molSO42-,质量增加0.5×96=48g,故A正确;B、放电时铅蓄电池负极发生氧化反应,而不是还原反应,故B错误;C、c是阴极产生氢气、d电极是阳极产生氧气,c、d电极产生气体的物质的量之比为2:1,故C错误;D、X为正极,而不是负极,故D错误;故选A。

练习册系列答案
相关题目