题目内容
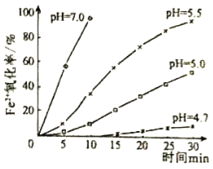
【题目】久置的FeSO4溶液变黄,一般认为是二价铁被氧化为三价铁的缘故。某研究小组为研究溶液中Fe2+被O2氧化的过程,查阅资料发现:溶液中Fe2+的氧化过程分为先后两步,首先是Fe2+水解,接着水解产物被O2氧化。于是小组同学决定研究常温下不同pH对Fe2+被O2氧化的影响,并测定了Fe2+氧化率随时间变化的关系,结果如图。回答下列问题:
(1)写出Fe2+水解的离子方程式______;要抑制FeSO4水解,可以采取的措施是______。
(2)在酸性条件下,Fe2+被O2氧化的反应方程式为:4Fe2++O24Fe3++2H2O,已知常温下该反应的平衡常数很大。则下列说法正确的是______。
a.Fe2+转化为Fe3+的趋势很大 b.Fe2+转化为Fe3+的速率很大
c.该反应进行得很完全 d.酸性条件下Fe2+不会被氧化
(3)结合如图分析不同pH对Fe2+被O2氧化的反应发生了怎样的影响______。
(4)研究小组在查阅资料时还得知:氧气的氧化性随溶液的酸性增强而增强。通过以上研究可知,配制FeSO4溶液的正确做法是______。
(5)用K2Cr2O7标准溶液测定溶液中Fe2+浓度,从而计算Fe2+的氧化率。反应如下:6Fe2++Cr2O72-+14H+→2Cr3++6Fe3++7H2O若取20mL待测溶液,用0.0200molL-1KCr2O7标准溶液滴定,消耗标准溶液16.50mL,则溶液中c(Fe2+)=______molL-1。
【答案】Fe2++2H2OFe(OH)2+2H+ 向溶液中滴加少量稀硫酸 ac pH越大氧化率越大 向其中加入少量的硫酸和铁粉等 0.099
【解析】
(1)Fe2+在溶液中水解使溶液呈酸性,滴加少量稀硫酸,增大溶液中氢离子浓度,使水解平衡逆向进行;
(2)依据题给信息平衡常数很大和题给图像分析;
(3)根据图象可知,溶液pH越大,亚铁离子被氧化的曲线斜率越大;
(4)加入少量铁粉能防止亚铁离子被氧化加入少量硫酸能防止亚铁离子水解;
(5)依据化学方程式计算。
(1)Fe2+在溶液中水解使溶液呈酸性,水解的离子方程式为Fe2++2H2OFe(OH)2+2H+,要抑制FeSO4水解,可以采取的措施是向溶液中滴加少量稀硫酸,增大溶液中氢离子浓度,使水解平衡逆向进行,故答案为:Fe2++2H2OFe(OH)2+2H+;向溶液中滴加少量稀硫酸;
(2)a、已知常温下4Fe2++O24Fe3++2H2O的平衡常数很大,说明Fe2+转化为Fe3+的趋势很大,故a正确;
b、根据图象可知,Fe2+转化为Fe3+的速率与溶液pH有关,pH=4.7时反应速率较小,故b错误;
c、该反应为可逆反应,平衡常数很大,反应进行的很完全,故c正确;
d、根据图象可知,酸性条件下Fe2+的氧化速率较小,但仍然会被氧化,故d错误;
ac正确,故答案为:ac;
(3)根据图象可知,溶液pH越大,亚铁离子被氧化的曲线斜率越大,说明pH越大氧化率越大,故答案为:pH越大氧化率越大;
(4)氧气的氧化性随溶液的酸性增强而增强,为了防止亚铁离子被氧化,配制FeSO4溶液时需要加入少量铁粉;为了防止亚铁离子水解,还需要加入少量硫酸,即向配制FeSO4溶液的方法是:加入少量的硫酸和铁粉等,故答案为:向其中加入少量的硫酸和铁粉等;
(5)取20mL待测溶液,用0.0200molL-1KCr2O7标准溶液滴定,消耗标准溶液16.50mL,n(KCr2O7)=0.0200molL-1×16.50×10-3L=3.3×10-4mol,根据反应可知,n(Fe2+)=6n(KCr2O7)=3.3×10-4mol×6=1.98×10-3mol,则溶液中c(Fe2+)=1.98×10-3mol /0.02L=0.099mol/L,故答案为:0.099。

 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案【题目】地球上的物质不断变化,数10亿年来大气的成分也发生了很大的变化。下表是原始大气和目前空气的主要成分:
目前空气的成分 | N2、O2、CO2、水蒸气及稀有气体(如He、Ne等) |
原始氮气的主要成分 | CH4、NH3、CO、CO2等 |
用上表所涉及的分子填写下列空白。
(1)含有10个电子的分子有(填化学式,下同)______________________;
(2)由极性键构成的非极性分子有____________________;
(3)与H+可直接形成配位键的分子有________;
(4)沸点最高的物质是________,用所学的知识解释其沸点最高的原因_____________;
(5)分子中不含孤电子对的分子(稀有气体除外)有________,它的立体构型为________;
(6)极易溶于水、且水溶液呈碱性的物质的分子是________,它之所以极易溶于水是因为它的分子和水分子之间形成________;
(7)CO的结构可表示为O![]() C,与CO结构最相似的分子是________,这两种结构相似的分子中,分子的极性________(填“相同”或“不相同”),CO分子中有一个键的形成与另外两个键不同,它叫________。
C,与CO结构最相似的分子是________,这两种结构相似的分子中,分子的极性________(填“相同”或“不相同”),CO分子中有一个键的形成与另外两个键不同,它叫________。
【题目】下表为部分短周期非金属元素的性质或原子结构,已知A﹣D的原子序数依次增大。
元素编号 | 元素性质或原子结构 |
A | A原子所处的周期数、族序数、原子序数均相等 |
B | 核外电子有6种不同运动状态 |
C | 最简单氢化物的水溶液呈碱性 |
D | 基态原子的s轨道电子数等于p轨道电子数 |
请结合表中信息完成下列各小题(答题时用所对应的元素符号):
(1)写出C原子的电子排布图________。
(2)A,B,C,D的第一电离能由大到小的顺序为________。
(3)用电离方程式表示C的最简单氢化物的水溶液呈碱性的原因________。按照共价键理论,分子中每个原子的最外电子层电子数均已饱和,已知ABCD分子可能有三种不同结构,它们的结构可以从其他物质的结构中获得启发。
(4)ABC的结构式是______,向其中插入一个D原子,若形成配位键(用→表示)则ABCD的结构式为_______,分子中C的原子的杂化类型是______;若无配位键则ABCD的结构式为______分子中D原子的杂化类型为________。
(5)BD2的电子式是________将D原子换成等电子的 ![]() 所得ABCD的结构式为_______,分子中C原子的杂化类型是_______。
所得ABCD的结构式为_______,分子中C原子的杂化类型是_______。
(6)在ABCD的三种可能结构中B原子的杂化类型________(填“相同”或“不相同”)。
【题目】某学习小组研究溶液中Fe2+的稳定性,进行如下实验,观察,记录结果。

实验Ⅰ
物质 | 0 min | 1min | 1h | 5h |
FeSO4 | 淡黄色 | 桔红色 | 红色 | 深红色 |
(NH4)2Fe(SO4)2 | 几乎无色 | 淡黄色 | 黄色 | 桔红色 |
(1)上述(NH4)2Fe(SO4)2溶液pH小于FeSO4的原因是_______(用化学用语表示)。溶液的稳定性:FeSO4_______(NH4)2Fe(SO4)2(填“>”或“<”) 。
(2)甲同学提出实验Ⅰ中两溶液的稳定性差异可能是(NH4)2Fe(SO4)2溶液中的NH4+保护了Fe2+,因为NH4+具有还原性。进行实验Ⅱ,否定了该观点,补全该实验。
操作 | 现象 |
取_______,加_______,观察。 | 与实验Ⅰ中(NH4)2Fe(SO4)2溶液现象相同。 |
(3)乙同学提出实验Ⅰ中两溶液的稳定性差异是溶液酸性不同导致,进行实验Ⅲ:分别配制0.80 mol·L-1 pH为1、2、3、4的FeSO4溶液,观察,发现pH=1的FeSO4溶液长时间无明显变化,pH越大,FeSO4溶液变黄的时间越短。
资料显示:亚铁盐溶液中存在反应 4Fe2++O2+10H2O ![]() 4Fe(OH)3+8H+
4Fe(OH)3+8H+
由实验III,乙同学可得出的结论是_______,原因是_______。
(4)进一步研究在水溶液中Fe2+的氧化机理。测定同浓度FeSO4溶液在不同pH条件下,Fe2+的氧化速率与时间的关系如图(实验过程中溶液温度几乎无变化)。反应初期,氧化速率都逐渐增大的原因可能是_____。

(5)综合以上实验,增强Fe2+稳定性的措施有_______。