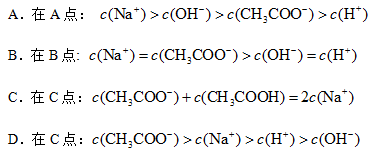题目内容
水的电离过程为H2O H++OH-,在不同温度下其平衡常数为K(25℃)=1.0×10-14,K(35℃)=2.1×10-14。则下列叙述不正确的是 ( )
H++OH-,在不同温度下其平衡常数为K(25℃)=1.0×10-14,K(35℃)=2.1×10-14。则下列叙述不正确的是 ( )
 H++OH-,在不同温度下其平衡常数为K(25℃)=1.0×10-14,K(35℃)=2.1×10-14。则下列叙述不正确的是 ( )
H++OH-,在不同温度下其平衡常数为K(25℃)=1.0×10-14,K(35℃)=2.1×10-14。则下列叙述不正确的是 ( )| A.c(H+)随着温度升高而升高 | B.35℃时,c(H+)>c(OH-) |
C.水的电离度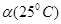 < <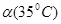 | D.水的电离是吸热的 |
B
试题分析:根据不同温度下水的离子积可知升高温度,平衡正向移动,所以水的电离是吸热的,c(H+)、c(OH-)随着温度升高而升高,但c(H+)=c(OH-),所以B项错误。答案选B。
点评:温度升高水的电离程度增大,但是c(H+)=c(OH-),溶液呈中性。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
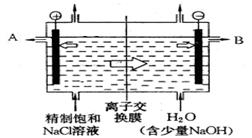
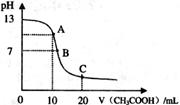
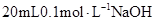 溶液
溶液 中逐滴加入
中逐滴加入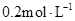 醋酸溶液,pH的变
醋酸溶液,pH的变