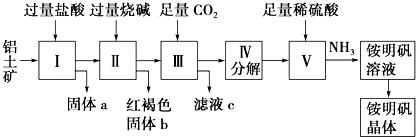
��Ŀ����
����Ŀ����ΪԪ�����ڱ���һ���֣�
̼ | �� | Y | |
X | �� | Z |
���ж� X��Y��Z��������Ӧ��Ԫ�ط��Żش��������⣮
��1��X�� �� ����ԭ��M��������� ��
��2������Ԫ��ԭ�Ӱ뾶������ ��
��3��Y��Ԫ�����ڱ��е�λ���ǵ����ڵ��壬�õ���ʽ��ʾY������⻯����γɹ��� ��
��4�������е�ԭ��֮��Ļ�ѧ�����������ɵ�����������Ӧ����1mol����ʱת�Ƶ��ӵ���Ŀ��NA ��
��5������Z����Ԫ����ȣ��ǽ�����ǿ���� �� ���û�ѧ����ʽ˵����һ���� ��
��6��̼������Y����Ԫ�ص������̬�⻯����ȶ�����ǿ������˳���� �� �����̼Ԫ������ͼ۵�Ԫ����ɻ�����Ļ�ѧʽ�� ��
���𰸡�
��1��Si��4
��2��Si
��3�������� A��![]()
��4�����ۼ���3
��5��Cl��H2S+Cl2=S��+2HCl
��6��H2O��NH3��CH4��C3N4
���������⣺��1�����ݸ�Ԫ�����λ�ÿ�֪��Xλ��̼����һ���壬ΪSiԪ�أ�Si�����M�㺬��4�����ӣ����Դ��ǣ�Si�� 4����2��SiԪ��λ�ڵ������ڣ��ұ��е�������Ԫ����Si��ԭ��������С����Si��ԭ�Ӱ뾶������Դ��ǣ�Si����3��Y��Sλ��ͬһ���壬��YΪOԪ�أ�λ�����ڱ��еڶ����ڢ�A��O���⻯��Ϊˮ��ˮ����Ϊ���ۻ�����õ���ʽ��ʾ���γɹ���Ϊ ![]() �����Դ��ǣ�������A��
�����Դ��ǣ�������A�� ![]() ����4�������е�ԭ��֮��Ļ�ѧ�����ڹ��ۼ�������������NԪ�صĻ��ϼ�Ϊ��3�ۣ����ɵ�����������Ӧ����1mol����ʱת����3mol���ӣ�ת�Ƶ��ӵ���Ŀ��3NA �� ���Դ��ǣ����ۼ���3����5��Z��S��ԭ��������1����ԭ������Ϊ17����ClԪ�أ�Cl��Sλ��ͬһ���ڣ�ԭ������Խ�ǽ�����Խǿ����Cl�ķǽ����Խ�ǿ��ͨ����Ӧ H2S+Cl2=S��+2HCl����֤�������Դ��ǣ�Cl�� H2S+Cl2=S��+2HCl����6���ǽ����ԣ�O��N��C����̼������O����Ԫ�ص������̬�⻯����ȶ�����ǿ������˳���ǣ�H2O��NH3��CH4 �� ̼Ԫ�����̼Ϊ+4��N����ͼ۵�Ϊ��3�������̼Ԫ������ͼ۵�Ԫ����ɻ�����Ļ�ѧʽC3N4 �� ���Դ��ǣ�H2O��NH3��CH4��C3N4 ��
����4�������е�ԭ��֮��Ļ�ѧ�����ڹ��ۼ�������������NԪ�صĻ��ϼ�Ϊ��3�ۣ����ɵ�����������Ӧ����1mol����ʱת����3mol���ӣ�ת�Ƶ��ӵ���Ŀ��3NA �� ���Դ��ǣ����ۼ���3����5��Z��S��ԭ��������1����ԭ������Ϊ17����ClԪ�أ�Cl��Sλ��ͬһ���ڣ�ԭ������Խ�ǽ�����Խǿ����Cl�ķǽ����Խ�ǿ��ͨ����Ӧ H2S+Cl2=S��+2HCl����֤�������Դ��ǣ�Cl�� H2S+Cl2=S��+2HCl����6���ǽ����ԣ�O��N��C����̼������O����Ԫ�ص������̬�⻯����ȶ�����ǿ������˳���ǣ�H2O��NH3��CH4 �� ̼Ԫ�����̼Ϊ+4��N����ͼ۵�Ϊ��3�������̼Ԫ������ͼ۵�Ԫ����ɻ�����Ļ�ѧʽC3N4 �� ���Դ��ǣ�H2O��NH3��CH4��C3N4 ��

 ��ĩ1�����ʽ���������ϵ�д�
��ĩ1�����ʽ���������ϵ�д�