题目内容
【题目】铝是重要的金属材料,铝土矿(主要成分是Al2O3和少量的SiO2、Fe2O3杂质)是工业上制取铝的原料.实验室模拟工业上以铝土矿为原料制取Al2(SO4)3和铵明矾晶体[NH4Al(SO4)212H2O]的工艺流程如图所示: 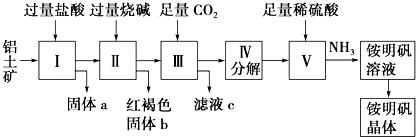 请回答下列问题:
请回答下列问题:
(1)固体a的化学式为 , Ⅲ中通入足量CO2气体发生反应的离子方程式为 .
(2)由Ⅴ 制取铵明矾溶液的化学方程式为 . 从铵明矾溶液中获得铵明矾晶体的实验操作依次为(填操作名称)、冷却结晶、过滤洗涤.
(3)以1000kg含氧化铝36%的铝土矿为原料制取Al2(SO4)3 , 需消耗质量分数98%的硫酸(密度1.84gcm﹣1)L(计算结果请保留一位小数).
(4)若同时制取铵明矾和硫酸铝,通过控制硫酸的用量调节两种产品的产量.若欲使制得的铵明矾和硫酸铝的物质的量之比为1:1,则投料时铝土矿中的Al2O3和H2SO4的物质的量之比为 .
【答案】
(1)SiO2;AlO2﹣+CO2+2H2O═HCO3﹣+Al(OH)3↓
(2)Al2O3+4H2SO4+2NH3═2NH4Al(SO4)2+3H2O;蒸发浓缩
(3)575.4
(4)3:10
【解析】解:(1)铝土矿中Al2O3和Fe2O3能溶于盐酸,SiO2不溶于盐酸,所以固体a的化学式为SiO2 , Al2O3溶于烧碱生成NaAlO2溶液,在其中通入CO2生成Al(OH)3沉淀,所以答案是:SiO2; AlO2﹣+CO2+2H2O═HCO3﹣+Al(OH)3↓;(2)Al(OH)3分解生成Al2O3 , Al2O3与稀硫酸、氨气反应生成铵明矾溶液,从铵明矾溶液中获得铵明矾晶体的实验操作依次为蒸发浓缩、冷却结晶、过滤洗涤,所以答案是:Al2O3+4H2SO4+2NH3═2NH4Al(SO4)2+3H2O;蒸发浓缩;(3)m(Al2O3)=1 000 kg×36%=360 kg, 依据:
Al2O3+ | 3H2SO4=Al2(SO4)3+3H2O |
102 | 294 |
360kg | m(H2SO4) |
故m(H2SO4)= ![]() =1037.6 kg,需消耗质量分数98%的硫酸(密度1.84 gcm﹣3)为=
=1037.6 kg,需消耗质量分数98%的硫酸(密度1.84 gcm﹣3)为= ![]() =575.4 L,
=575.4 L,
所以答案是:575.4;(4)设制得的Al2(SO4)3和NH4Al(SO4)212H2O的物质的量都是1 mol,则Al3+共3 mol,SO42﹣共5 mol,根据Al3+和SO42﹣守恒原理可得,加入Al2O3和H2SO4的物质的量之比为: ![]() :5=3:10,所以答案是:3:10.
:5=3:10,所以答案是:3:10.

【题目】表为元素周期表的一部分.
碳 | 氮 | Y | |
X | 硫 | Z |
请判断 X、Y、Z,并用相应的元素符号回答下列问题.
(1)X是 , 它的原子M层电子数是 .
(2)表中元素原子半径最大的是 .
(3)Y在元素周期表中的位置是第周期第族,用电子式表示Y的最简单氢化物的形成过程 .
(4)氮气中氮原子之间的化学键属于键,由氮气与氢气反应生成1mol氨气时转移电子的数目是NA .
(5)硫与Z两种元素相比,非金属性强的是 , 请用化学方程式说明这一结论 .
(6)碳、氮、Y三种元素的最简单气态氢化物的稳定性由强到弱的顺序是 . 由最高价碳元素与最低价氮元素组成化合物的化学式是 .