题目内容
6.实验室常用二氧化锰和浓盐酸共热的方法制取氯气,反应中二氧化锰被还原为MnCl2.根据要求回答下列问题.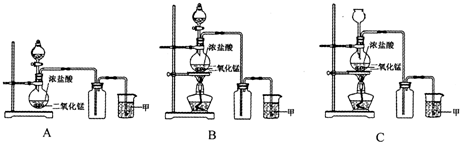
(1)A、B、C三套装置中,应选用的装置是B(选填“A”、“B”、“C”);
(2)写出实验室用上述方法制取氯气的化学方程式MnO2+4HCl△_△––––––MnCl2+Cl2↑+2H2O
(3)为了防止氯气污染环境,图中所示的溶液甲为氢氧化钠溶液,在该溶液中发生反应的化学方程式2NaOH+Cl2═NaCl+NaClO+H2O.
(4)利用该原理和装置制得的氯气往往含有HCl和H2O杂质,其中含有的HCl杂质可用饱和食盐水除去.
分析 (1)用二氧化锰和浓盐酸共热的方法制取氯气,氯气比空气重,用向上排气法收集;
(2)二氧化锰和浓盐酸共热的方法制取氯气,反应中二氧化锰被还原为MnCl2;
(3)氯气是有毒的污染性气体,不能排放到空气中,需要用氢氧化钠溶液吸收;
(4)氯气往往含有HCl和H2O杂质,其中含有的HCl杂质可以用饱和食盐水吸收.
解答 解:(1)用二氧化锰和浓盐酸共热的方法制取氯气,氯气比空气重,用向上排气法收集,装置A无加热装置,B符合制备装置,C中氯气会从长颈漏斗中跑出,
故答案为:B;
(2)二氧化锰和浓盐酸共热的方法制取氯气,反应中二氧化锰被还原为MnCl2,反应的化学方程式为:MnO2+4HCl△_△––––––MnCl2+2H2O+Cl2↑,
故答案为:MnO2+4HCl△_△––––––MnCl2+2H2O+Cl2↑;
(3)氯气是有毒的污染性气体,不能排放到空气中,需要用氢氧化钠溶液吸收,反应的化学方程式为:2NaOH+Cl2═NaCl+NaClO+H2O,
故答案为:氢氧化钠溶液;2NaOH+Cl2═NaCl+NaClO+H2O;
(4)氯气往往含有HCl和H2O杂质,其中含有的HCl杂质极易溶于水,氯气在饱和食盐水中溶解度不大,可以用饱和食盐水吸收,故答案为:饱和食盐水.
点评 本题考查了实验室制备氯气的方法和原理分析判断,主要是装置选择和反应化学方程式书写,掌握基础是关键,题目难度中等.

练习册系列答案
相关题目
17.在标准状况下,下列气体中的物质的量最大的是( )
| A. | CO2,100 mL | B. | O2,200 mL | C. | N2,400 mL | D. | CH4,600 mL |
1.下列物质既能由金属和酸反应获得,也能通过金属和氯气反应获得的是( )
| A. | CuCl2 | B. | FeCl2 | C. | FeCl3 | D. | NaCl |
11.在无色透明的强酸性溶液中,能大量共存的离子组是( )
| A. | K+、Ba2+、NO3-、SO42- | B. | K+、Na+、Cl-、ClO- | ||
| C. | Ca2+、NH4+、NO3-、Cl- | D. | K+、Na+、MnO4-、SO42- |
15.下列关于碱金属的叙述中正确的是( )
| A. | K能从LiCl的溶液中置换出Li | |
| B. | 随着原子序数的递增,单质与水反应的剧烈程度减弱 | |
| C. | 随着原子序数的递增,单质熔点逐渐降低 | |
| D. | Cs2CO3受热易分解 |
 +RMgX→
+RMgX→

 ,
, .
.
 .
.