题目内容
【题目】将等物质的量A、B混合于2L的密闭容器中,发生如下反应:3A(g) + B(g)xC(g) + 2D(g),经4min后,测得D的浓度为0.4mol/L,c(A)︰c(B)=3︰5,C的平均反应速率是0.1 mol·(L ·min) -1。下列说法错误的是
A.A在4min末的浓度是0.6mol/LB.B在4min内的平均反应速率0.05 mol.L -1·min -1
C.x值是1D.起始时物质A的浓度为2.4mol/L
【答案】CD
【解析】
A.4min内△c(D)=0.4mol/L,根据方程式可知△c(A)=![]() ×0.4mol/L=0.6mol/L,△c(B)=
×0.4mol/L=0.6mol/L,△c(B)=![]() ×0.4mol/L=0.2mol/L,令A、B的起始浓度为a mol/L,则:(a-0.6):(a-0.2)=3:5,解得a=1.2,故4min末时A的浓度=1.2mol/L-0.6mol/L=0.6mol/L,故A正确;
×0.4mol/L=0.2mol/L,令A、B的起始浓度为a mol/L,则:(a-0.6):(a-0.2)=3:5,解得a=1.2,故4min末时A的浓度=1.2mol/L-0.6mol/L=0.6mol/L,故A正确;
B.4min内△c(B)=0.2mol/L,反应速率为![]() =0.05 mol·L -1·min -1,故B正确;
=0.05 mol·L -1·min -1,故B正确;
C.4min内v(D)=![]() =0.1mol·L -1·min -1,v(D):v(C)=1:1,所以x=2,故C错误;
=0.1mol·L -1·min -1,v(D):v(C)=1:1,所以x=2,故C错误;
D.根据A选项可知物质A的浓度为1.2mol/L,故D错误;
综上所述答案为CD。

练习册系列答案
相关题目
【题目】如图所示装置中,观察到电流计指针偏转;M棒变粗,N棒变细,由此判断下表中所列M、N、P物质,其中可以成立的是( )
M | N | P | |
A | 锌 | 铜 | 稀硫酸溶液 |
B | 铜 | 锌 | 稀盐酸溶液 |
C | 银 | 锌 | 硝酸银溶液 |
D | 锌 | 铁 | 硝酸铁溶液 |
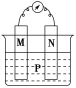
A.AB.BC.CD.D