题目内容
【题目】氯和碘是ⅦA元素,回答下列问题:
(1)I3-中心原子的价层电子对数为_______ ,沸点ICl____Cl2(填大于,小于,等于)。
(2)已知CsICl2受热分解,该分解的化学方程式是___________________。
(3)已知高碘酸的结构如图1所示,1mol高碘酸中含有__________mol![]() 键。
键。
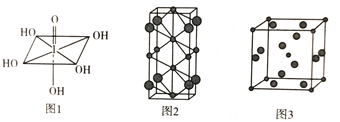
(4)Na和Cl两种元素可以形成不同类型的晶体,如图2和图3(大球为氯原子,小球为钠原子),图2化学式为_____________;图3中Na+的配位数为___________。
(5)若图3晶胞的边长为a cm,则晶体的密度![]() =____(NA表示阿伏加德罗常数的值)。
=____(NA表示阿伏加德罗常数的值)。
【答案】5 大于 CsICl2 ![]() CsCl + ICl 11 Na2Cl 12
CsCl + ICl 11 Na2Cl 12 ![]() gcm-3
gcm-3
【解析】
根据中心原子的价层电子对数计算公式计算,根据晶体类型及微粒间作用力比较熔沸点;根据物质的稳定性及原子守恒分析反应产物书写反应方程式;根据物质结构图及成键方式计算σ键数目;根据晶胞的结构计算晶胞密度并书写化学式。
(1)中心原子的价层电子对数(注意可不是价电子数)=中心原子孤电子对数+中心原子与周围原子形成σ键电子对数,I3-根据价层电子对互斥理论计算出孤电子对数为3,成键电子对数为2,因此价层电子对数为5;ICl和Cl2属于分析晶体,组成和结构相似,相对分子质量越大,分子间作用力越强,则沸点越高,则沸点ICl大于Cl2,故答案为:5;大于;
(2)由于CsCl的晶格能大于CsI,更稳定,因此产物CsCl 和 ICl,反应方程式为:CsICl2 ![]() CsCl + Icl,故答案为:CsICl2
CsCl + Icl,故答案为:CsICl2 ![]() CsCl + ICl;
CsCl + ICl;
(3)单键为σ键,双键中有1个σ键,所以根据高碘酸的结构可知1 mol高碘酸中含有11 mol σ键,故答案为:11;
(4)图2中Na+个数为2+2×1/2+4×1/4=4,Cl-个数为8×1/4=2,故化学式为Na2Cl; Na+的配位数即为与Na+紧邻的Cl-数,图3中与Na+位于体心,Cl-位于每个面的面上,一共有6个面,每个面有两个,所以与Na+紧邻的Cl-共12个,故答案为:Na2Cl;12;
(5)图3晶胞中含有钠离子数目为:8×1/8+1=2,氯离子数目为:2×1/2×6=6,则晶胞的质量为:![]() ,晶胞的边长为a cm,则体积为a3 cm3,所以晶胞的密度
,晶胞的边长为a cm,则体积为a3 cm3,所以晶胞的密度![]() =
=![]() gcm-3,故答案为:
gcm-3,故答案为: ![]() gcm-3。
gcm-3。

 阅读快车系列答案
阅读快车系列答案【题目】实验室以苯甲醛为原料制备间溴苯甲醛的反应如下:
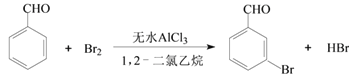
已知:①间溴苯甲醛温度过高时易被氧化。②溴、苯甲醛、1,2-二氯乙烷、间溴苯甲醛的沸点及相对分子质量见下表:
物质 | 溴 | 苯甲醛 | 1,2-二氯乙烷 | 间溴苯甲醛 |
沸点/℃ | 58.8 | 179 | 83.5 | 229 |
相对分子质量 | 160 | 106 | 185 |
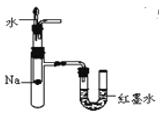
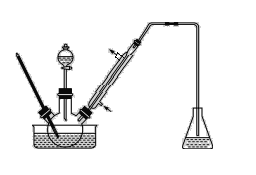
步骤1:将一定配比的无水AlCl3、1,2-二氯乙烷和苯甲醛充分混合后装入三颈烧瓶(如图所示),缓慢滴加经浓硫酸干燥过的足量液溴,控温反应一段时间,冷却。
步骤2:将反应混合物缓慢加入一定量的稀盐酸中,搅拌、静置、分液。有机层用10% NaHCO3溶液洗涤。
步骤3:经洗涤的有机层加入适量无水MgSO4固体,放置一段时间后过滤出MgSO4nH2O晶体。
步骤4:分离有机层,收集相应馏分。
(1)实验装置中盛装液溴的仪器名称是_____,锥形瓶中的试剂为NaOH溶液其作用为________。
(2)步骤1反应过程中,为提高原料利用率,适宜的温度范围为(填序号)___。
A.>229℃ B.58.8℃~179℃ C.<58.8℃
(3)步骤2中用10% NaHCO3溶液洗涤,是为了除去溶于有机层的___(填化学式)。
(4)步骤4中采用何种蒸馏方式_______,其目的是为了防止________。
(5)若实验中加入了5.3 g苯甲醛,得到3.7 g间溴苯甲醛。则间溴苯甲醛产率为______。
【题目】在一定体积的密闭容器中进行化学反应:CO2(g)+H2(g)![]() CO(g)+H2O(g),其化学平衡常数和温度的关系如下表所示:
CO(g)+H2O(g),其化学平衡常数和温度的关系如下表所示:
t/℃ | 700 | 800 | 830 | 1 000 | 1 200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K=____________。
(2)该反应为____________(填“吸热”或“放热”)反应。
(3)某温度下,平衡浓度符合下式c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为____________℃。
(4)在800 ℃时,发生上述反应,某一时刻测得容器内各物质的浓度分别为c(CO2)=2 mol·L-1,c(H2)=1.5 mol·L-1,c(CO)=1 mol·L-1,c(H2O)=3 mol·L-1,则下一时刻,反应____________(填“正向”或“逆向”)进行。