题目内容
(7分) 铜和浓硫酸发生反应的化学方程式为:
Cu +2H2SO4(浓) CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
(1)浓H2SO4作_________剂,具有 性。
(2)在该反应中,若消耗了32 g Cu,则转移了_______mol 电子 ,还原了 mol H2SO4,生成 L SO2(标准状况)气体。
(3)以下三种物质的氧化性由强到弱的顺序为: (写出序号)
① 浓H2SO4 ②稀H2SO4 ③CuSO4
Cu +2H2SO4(浓)
 CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O(1)浓H2SO4作_________剂,具有 性。
(2)在该反应中,若消耗了32 g Cu,则转移了_______mol 电子 ,还原了 mol H2SO4,生成 L SO2(标准状况)气体。
(3)以下三种物质的氧化性由强到弱的顺序为: (写出序号)
① 浓H2SO4 ②稀H2SO4 ③CuSO4
(1)氧化,氧化, (2)1 0.5 11.2 (3)①>③>②
Cu +2H2SO4(浓) CuSO4+SO2↑+2H2O 转移电子物质的量
CuSO4+SO2↑+2H2O 转移电子物质的量
因为:64g 被还原硫酸1mol 22.4L(标况) 2mole-
所以:32g 被还原硫酸0.5mol 11.2L(标况) 1mole-
根据氧化剂的氧化性大于氧化产物:浓H2SO4氧化性大于CuSO4 ;随着反应的进行硫酸浓度逐渐变稀,硫酸的氧化性逐渐减弱,当变成稀硫酸反应就不能进行了,所以CuSO4的氧化性大于稀H2SO4。
 CuSO4+SO2↑+2H2O 转移电子物质的量
CuSO4+SO2↑+2H2O 转移电子物质的量因为:64g 被还原硫酸1mol 22.4L(标况) 2mole-
所以:32g 被还原硫酸0.5mol 11.2L(标况) 1mole-
根据氧化剂的氧化性大于氧化产物:浓H2SO4氧化性大于CuSO4 ;随着反应的进行硫酸浓度逐渐变稀,硫酸的氧化性逐渐减弱,当变成稀硫酸反应就不能进行了,所以CuSO4的氧化性大于稀H2SO4。

练习册系列答案
 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案
相关题目
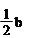
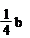
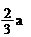
 氧化性从强到弱的顺序是 。
氧化性从强到弱的顺序是 。 MnCl2+C12↑+2H2O中,当有0.2mol电子转移时,产生氯气的体积(标准状况)是 。
MnCl2+C12↑+2H2O中,当有0.2mol电子转移时,产生氯气的体积(标准状况)是 。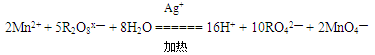
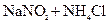 =
=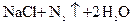 关于该反应的下列说法不正确的是
关于该反应的下列说法不正确的是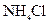 氮元素被还原
氮元素被还原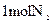 时,转移电子的物质的量为3mo1
时,转移电子的物质的量为3mo1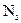 既是氧化产物,又是还原产物
既是氧化产物,又是还原产物