题目内容
将一定量的氯气通入30 mL浓度为10.00 mol/L的氢氧化钠浓溶液中,加热少许时间后溶液中形成NaCl、NaClO、NaClO3共存体系。下列判断正确的是
| A.与NaOH反应的氯气一定为0.15 mol |
| B.n(Na+)∶n(Cl-) 可能为7∶3 |
| C.若反应中转移的电子为n mol,则0.15 < n < 0.25 |
| D.n(NaCl)∶n(NaClO)∶n(NaClO3)可能为11∶2∶1 |
AC
A项:由原子守恒可知:Na和Cl是1:1,所以参加反应的氯气为0.15 mol;
B项:n(Na+)∶n(Cl-) 如若为7∶3 ,则可认为n(NaCl)为3mol,n(NaClO)和n(NaClO3)共4mol,则化合价升降不可能相等
C项:采用极值的方法,假设全部生成NaCl、NaClO时,电子转移为0.15 mol;假设全部生成NaCl、NaClO3时,电子转移为0.25 mol
D项:如果n(NaCl)∶n(NaClO)∶n(NaClO3)为11∶2∶1,则化合价升降不相等。
B项:n(Na+)∶n(Cl-) 如若为7∶3 ,则可认为n(NaCl)为3mol,n(NaClO)和n(NaClO3)共4mol,则化合价升降不可能相等
C项:采用极值的方法,假设全部生成NaCl、NaClO时,电子转移为0.15 mol;假设全部生成NaCl、NaClO3时,电子转移为0.25 mol
D项:如果n(NaCl)∶n(NaClO)∶n(NaClO3)为11∶2∶1,则化合价升降不相等。

练习册系列答案
相关题目
 ,如果不考虑反应过程中硝化细菌的增殖,其净反应如下式所示:
,如果不考虑反应过程中硝化细菌的增殖,其净反应如下式所示:
 的浓度为
的浓度为  。(假设反应前后溶液的体积不变)
。(假设反应前后溶液的体积不变) 2K2S+K2SO3+3H2O,则反应中氧化剂和还原剂的质量比是 ( )
2K2S+K2SO3+3H2O,则反应中氧化剂和还原剂的质量比是 ( )  CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O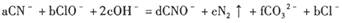
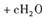 ,上述离子方程式可能的配平系数有多组。请回答:
,上述离子方程式可能的配平系数有多组。请回答: