题目内容
【题目】 研究碳及其化合物的相互转化对能源的充分利用、低碳经济有着重要的作用。
⑴已知:①CH4(g)+H2O(g)![]() CO(g)+3H2(g) △H1=+206.1kJ·mol-1
CO(g)+3H2(g) △H1=+206.1kJ·mol-1
②2H2(g)+CO(g)![]() CH3OH(l) △H2=-128.3kJ·mol-1
CH3OH(l) △H2=-128.3kJ·mol-1
③2H2(g)+O2(g)![]() 2H2O(g) △H3=-483.6kJ·mol-1
2H2O(g) △H3=-483.6kJ·mol-1
25℃时,在合适的催化剂作用下,采用甲烷和氧气一步合成液态甲醇的热化学方程式为 。
⑵利用反应①来制备氢气,为了探究温度、压强对反应①速率、转化率的影响,某同学设计了以下三组对比实验(温度为400℃或500℃,压强为101kPa或404kPa)。
实验序号 | 温度℃ | 压强/kPa | CH4初始浓度/ mol·L-1 | H2O初始浓度/ mol·L-1 |
1 | 400 | p | 3.0 | 7.0 |
2 | t | 101 | 3.0 | 7.0 |
3 | 400 | 101 | 3.0 | 7.0 |
①实验2和实验3相比,其平衡常数关系是K2 K3(填“>”、“<”或“=”)。
②将等物质的量的CH4和水蒸气充入1L恒容密闭容器中,发生上述反应,在400℃下达到平衡,平衡常数K=27,此时容器中CO物质的量为0.10mol,则CH4的转化率为 。
⑶ 科学家提出由CO2制 取 C的太阳能工艺如图1所示。
①“重整系统发生的反应中n(FeO):n(CO2)=6:1,则Fe xOy的化学式为______________。
②“热分解系统”中每分解l mol Fe xOy,转移电子的物质的量为___________。
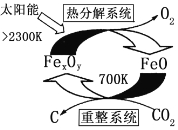

图1 图2
⑷pC类似pH,是指极稀溶液中的溶质浓度的常用负对数值。若某溶液中溶质的浓度为1×10-3mol·L-1,则该溶液中溶质的pC=-lg(1×10-3)=3。如图2为25℃时H2CO3溶液的pC-pH图。请回答下列问题 (若离子浓度小于10-5mol/L,可认为该离子不存在):
①在同一溶液中,H2CO3、HCO3-、CO32-____________(填“能”或“不能”)大量共存。
②求H2CO3一级电离平衡常数的数值Ka1=________________。
③人体血液里主要通过碳酸氢盐缓冲体系![]() 可以抵消少量酸或碱,维持pH=7.4。当过量的酸进入血液中时,血液缓冲体系中的
可以抵消少量酸或碱,维持pH=7.4。当过量的酸进入血液中时,血液缓冲体系中的![]() 最终将_________。
最终将_________。
A.变大 B.变小 C.基本不变 D.无法判断
【答案】
⑴CH4(g)+![]() O2(g)
O2(g)![]() CH3OH(l)△H1=-164.0kJ·mol-1
CH3OH(l)△H1=-164.0kJ·mol-1
⑵①>;②![]() (90.9%、90.91%、
(90.9%、90.91%、![]() ×100%均可)
×100%均可)
⑶①Fe3O4;②2mol
⑷①不能;②1×10-6;③A
【解析】
试题分析:⑴已知:①CH4(g)+H2O(g)![]() CO(g)+3H2(g) △H1=+206.1kJ·mol-1,
CO(g)+3H2(g) △H1=+206.1kJ·mol-1,
②2H2(g)+CO(g)![]() CH3OH(l) △H2=-128.3kJ·mol-1,
CH3OH(l) △H2=-128.3kJ·mol-1,
③2H2(g)+O2(g)![]() 2H2O(g) △H3=-483.6kJ·mol-1,
2H2O(g) △H3=-483.6kJ·mol-1,
根据盖斯定律,将①+![]() ×③+②得:CH4(g)+
×③+②得:CH4(g)+ ![]() O2(g)
O2(g)![]() CH3OH(l)
CH3OH(l)
△H1=(+206.1kJ·mol-1)+![]() (-483.6kJ·mol-1)+(-128.3kJ·mol-1)=-164.0kJ·mol-1,
(-483.6kJ·mol-1)+(-128.3kJ·mol-1)=-164.0kJ·mol-1,
故答案为:CH4(g)+ ![]() O2(g)
O2(g)![]() CH3OH(l)△H1=-164.0kJ·mol-1;
CH3OH(l)△H1=-164.0kJ·mol-1;
⑵①对比实验2、3,只有温度不同,其它条件相同,所以实验2、3的目的是探究温度对化学反应速率的影响;实验1、3温度相同,平衡常数相同,即K1=K3,比较实验1、2,实验2中温度高,温度升高,平衡向吸热方向移动,该反应为吸热反应,所以平衡向正反应方向移动,平衡常数增大,即K2>K1,所以K2>K3,故答案为:>;
②依据化学平衡的三段式列式计算,设CH4与H2O(g)物质的量为a,
CH4(g)+H2O(g) ![]() CO(g)+3H2(g)
CO(g)+3H2(g)
起始量(mol) a a 0 0
变化量(mol) 0.10 0.10
平衡量(mol) a-0.10 a-0.10 0.10 0.30
由平衡常数表达式:K=![]() =
=![]() =27,
=27,
解之得:a=0.11,平衡转化率:![]() ×100%=90.9%;
×100%=90.9%;
⑶①由示意图可知,重整系统中CO2和FeO反应生成FexOy和C,发生的反应中n(FeO):n(CO2)=6,根据Fe原子、O原子守恒可知x:y=6:(6+2)=3:4,故FexOy的化学式为Fe3O4,故答案为:Fe3O4;
②热分解系统中是Fe3O4分解为FeO与氧气,分解l mol Fe3O4转移电子的物质的量为1mol×3×(![]() -2)=2mol,故答案为:2mol;
-2)=2mol,故答案为:2mol;
(4)①碳酸存在的溶液中酸性较强、碳酸根离子存在的溶液中碱性较强,所以碳酸根离子和碳酸不能大量共存,故答案为:不能;
②由图象可知当pH=6时,pC(H2CO3)=pC(HCO3-),结合Ka1(H2CO3)=![]() =
=![]() =10-6,故答案为:10-6;
=10-6,故答案为:10-6;
③氢离子浓度增大,平衡向左移动放出CO2,碳酸浓度基本不变,则c(H+)/c(H2CO3)最终将变大,故选A。