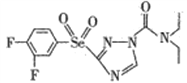
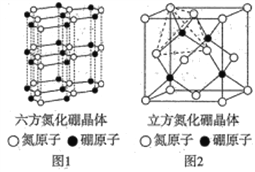
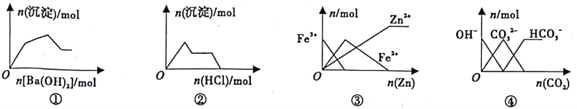
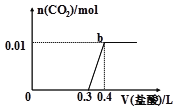
题目内容
【题目】NA为阿伏加德罗常数的值.下列说法正确的是( )
A.1L 0.1mol?L﹣1的NaHCO3溶液中HCO ![]() 和CO
和CO ![]() 离子数之和为0.1NA
离子数之和为0.1NA
B.50ml 12mol/L盐酸与足量MnO2共热,转移的电子数为0.3NA
C.过氧化钠与CO2反应时,生成0.1mol氧气转移的电子数为0.2NA
D.密闭容器中2molNO与1molO2充分反应,产物的分子数为2NA
【答案】C
【解析】解:A、HCO ![]() 在溶液中既能电离为CO
在溶液中既能电离为CO ![]() 又能水解为H2CO3 , 根据物料守恒可知,故1L 0.1molL﹣1的NaHCO3溶液中H2CO3、HCO
又能水解为H2CO3 , 根据物料守恒可知,故1L 0.1molL﹣1的NaHCO3溶液中H2CO3、HCO ![]() 和CO
和CO ![]() 离子数之和为0.1NA , 故A错误; B、二氧化锰只能与浓盐酸反应,与稀盐酸不反应,故盐酸不能反应完全,故转移的电子数小于0.3NA个,故B错误;
离子数之和为0.1NA , 故A错误; B、二氧化锰只能与浓盐酸反应,与稀盐酸不反应,故盐酸不能反应完全,故转移的电子数小于0.3NA个,故B错误;
C、过氧化钠与二氧化碳反应时,氧元素发生歧化反应,氧气由﹣1价变为0价,故当生成0.1mol氧气时转移0.2mol电子即0.2NA个,故C正确;
D、2molNO与1molO2充分反应生成2molNO2 , 但NO2存在平衡:2NO2N2O4 , 导致分子数减小,故产物的分子数小于2NA个,故D错误.
故选C.

【题目】某学生欲用已知物质的量浓度为0.1000mol/L的NaOH溶液来测定未知物质的量浓度的盐酸,选择酚酞作指示剂.请填写下列空白:![]()
(1)如图仪器的名称是 .
(2)用标准的氢氧化钠溶液滴定待测的盐酸时,左手挤压橡皮管中玻璃小球,右手摇动锥形瓶,眼睛注视 , 滴定终点的判断方法是 .
(3)根据下面表格数据,可计算出该盐酸的浓度约为(保留两位有效数字).
实验 | NaOH溶液的 | 滴定完成时,溶液滴入的体积/mL aOH | 待测盐的体积/mL酸 |
1 | 0.10 | 22.62 | 20.00 |
2 | 0.10 | 22.72 | 20.00 |
3 | 0.10 | 22.80 | 20.00 |
(4)在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有 .
A.滴定终点读数时俯视读数
B.酸式滴定管使用前,水洗后未用待测盐酸、润洗
C.锥形瓶水洗后未干燥
D.碱式滴定管尖嘴部分有气泡,滴定后消失.