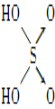题目内容
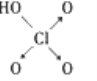
【题目】判断含氧酸酸性强弱的一条经验规律是:含氧酸分子结构中含非羟基氧原子数越多,该含氧酸的酸性越强。如下表所示:
含氧酸酸性强弱与非羟基氧原子数的关系
次氯酸 | 磷酸 | 硫酸 | 高氯酸 | |
含氧酸 | Cl—OH |
|
|
|
非羟基氧原子数 | 0 | 1 | 2 | 3 |
酸性 | 弱酸 | 中强酸 | 强酸 | 最强酸 |
(1)已知,亚磷酸是中强酸,亚砷酸是弱酸且有一定的弱碱性,则H3PO3和H3AsO3与过量的NaOH溶液反应的化学方程式分别是①_____________________________,②__________________________________。
(2)在H3PO3和H3AsO3中分别加入浓盐酸,分析反应情况______________,写出化学方程式:____________________________________________________。
【答案】H3PO3+2NaOH=Na2HPO3+2H2O H3AsO3+3NaOH=Na3AsO3+3H2O 亚磷酸为中强酸与盐酸不反应,亚砷酸与盐酸反应 H3AsO3+3HCl=AsCl3+3H2O
【解析】
(1)与过量NaOH溶液反应的化学方程式的书写,需得知H3PO3和H3AsO3分别为几元酸。
(2)亚磷酸为中强酸与盐酸不反应,亚砷酸与盐酸反应。
(1)从题给信息可知,含氧酸分子结构中含几个羟基氢,则该酸为几元酸。故H3PO3为二元酸,H3AsO3为三元酸,则H3PO3和H3AsO3与过量的NaOH溶液反应的化学方程式分别是①H3PO3+2NaOH=Na2HPO3+2H2O;②H3AsO3+3NaOH=Na3AsO3+3H2O;
(2)H3PO3为中强酸,不与盐酸反应;H3AsO3为两性物质,可与盐酸反应。亚砷酸与盐酸反应的化学方程式为H3AsO3+3HCl=AsCl3+3H2O。

 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案