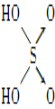题目内容
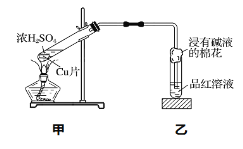
【题目】某小组同学利用如图所示装置探究氨气的性质。

请回答:
(1)实验室用NH4Cl和Ca(OH)2共热制取氨气,该反应的化学方程式是_____。
(2)①中湿润的红色石蕊试纸变蓝,说明氨气的水溶液显______(填字母)。
a.碱性 b.还原性
(3)向②中滴入浓盐酸,现象是_____。
(4)下列装置中,能用于本实验中尾气吸收的是______(填字母)。
a. b.
b.
【答案】Ca(OH)2+2NH4Cl![]() CaCl2+2NH3↑+2H2O a 有白烟生成 b
CaCl2+2NH3↑+2H2O a 有白烟生成 b
【解析】
实验室用加热氯化铵和氢氧化钙混合物的方法制取氨气;氨气易溶于水,氨水显碱性;氨气与氯化氢反应生成氯化铵固体;根据氨气极易溶于水的性质和实验安全进行判断。
(1)在加热条件下,氯化铵和氢氧化钙反应生成氯化钙、氨气和水,反应方程式为:Ca(OH)2+2NH4Cl![]() CaCl2+2NH3↑+2H2O;
CaCl2+2NH3↑+2H2O;
(2)氨气极易溶于水,氨气和水反应生成一水合氨,一水合氨电离出氢氧根离子和铵根离子而使溶液呈碱性,①中湿润的红色石蕊试纸变蓝;
(3)向②中滴入浓盐酸,浓盐酸挥发出的HCl遇NH3反应生成氯化铵固体,氯化铵固体是白色固体小颗粒,有白烟生成;
(4)氨气极易溶于水,为防止倒吸,可以选用b装置,增大接触面积,若使用a装置,这种密闭型的容器不能很好的吸收氨气,故不使用它吸收氨气。

【题目】判断含氧酸酸性强弱的一条经验规律是:含氧酸分子结构中含非羟基氧原子数越多,该含氧酸的酸性越强。如下表所示:
含氧酸酸性强弱与非羟基氧原子数的关系
次氯酸 | 磷酸 | 硫酸 | 高氯酸 | |
含氧酸 | Cl—OH |
|
|
|
非羟基氧原子数 | 0 | 1 | 2 | 3 |
酸性 | 弱酸 | 中强酸 | 强酸 | 最强酸 |
(1)已知,亚磷酸是中强酸,亚砷酸是弱酸且有一定的弱碱性,则H3PO3和H3AsO3与过量的NaOH溶液反应的化学方程式分别是①_____________________________,②__________________________________。
(2)在H3PO3和H3AsO3中分别加入浓盐酸,分析反应情况______________,写出化学方程式:____________________________________________________。
【题目】二氧化碳资源化利用是目前研究的热点之一。
(1)二氧化碳可用于重整天然气制合成气(CO和H2)。
①已知下列热化学方程式:CH4(g)+H2O(g)![]() CO(g)+3H2(g) △H1=+206kJ/mol,CO2(g)+4H2(g)
CO(g)+3H2(g) △H1=+206kJ/mol,CO2(g)+4H2(g) ![]() CH4(g)+2H2O(g) △H 2=-165kJ/mol,
CH4(g)+2H2O(g) △H 2=-165kJ/mol,
则反应CH4(g)+CO2(g)![]() 2CO(g)+2H2(g)的△H=____kJ/mol。
2CO(g)+2H2(g)的△H=____kJ/mol。
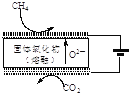
②最近我国学者采用电催化方法用CO2重整CH4制取合成气,装置如图所示。装置工作时,阳极的电极反应式为________。
(2)由二氧化碳合成VCB(锂电池电解质的添加剂)的实验流程如下,已知EC、VCB核磁共振氢谱均只有一组峰,均含五元环状结构,EC能水解生成乙二醇。
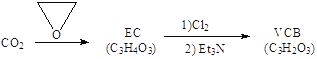
VCB的结构简式为_________。
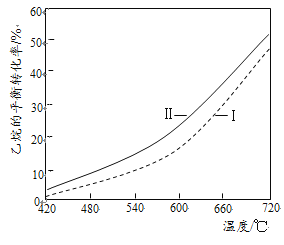
(3)乙烷直接热解脱氢和CO2氧化乙烷脱氢的相关化学方程式及平衡转化率与温度的关系如下:
(I)乙烷直接热解脱氢:C2H6(g)![]() C2H4(g)+H2(g) △H1
C2H4(g)+H2(g) △H1
(Ⅱ)CO2氧化乙烷脱氢:C2H6(g)+CO2(g)![]() C2H4(g)+CO(g)+H2O(g) △H2
C2H4(g)+CO(g)+H2O(g) △H2
①反应(I)的△H1= ____kJ/mol(填数值,相关键能数据如下表)。
化学键 | C-C | C=C | C-H | H-H |
键能/kJ·mol-1 | 347.7 | 615 | 413.4 | 436.0 |
②反应(Ⅱ)乙烷平衡转化率比反应(I)的大,其原因是______(从平衡移动角度说明)。
③有学者研究纳米Cr2O3催化CO2氧化乙烷脱氢,通过XPS测定催化剂表面仅存在Cr6+和Cr3+,从而说明催化反应历程为:C2H6(g)→C2H4(g)+H2(g),______和_______(用方程式表示,不必注明反应条件)。
④在三个容积相同的恒容密闭容器中,温度及起始时投料如下表所示,三个容器均只发生反应:C2H6(g)img src="http://thumb.zyjl.cn/questionBank/Upload/2019/10/07/08/dcc46cb6/SYS201910070801057716573811_ST/SYS201910070801057716573811_ST.001.png" width="33" height="10" style="-aw-left-pos:0pt; -aw-rel-hpos:column; -aw-rel-vpos:paragraph; -aw-top-pos:0pt; -aw-wrap-type:inline" />C2H4(g)+H2(g)。温度及投料方式(如下表所示),测得反应的相关数据如下:
容器1 | 容器2 | 容器3 | |
反应温度T/K | 600 | 600 | 500 |
反应物投入量 | 1molC2H6 | 2molC2H4+2molH2 | 1molC2H6 |
平衡时v正(C2H4)/ mol/(L·s) | v1 | v2 | v3 |
平衡时c(C2H4)/ mol/L | c1 | c2 | c3 |
平衡常数K | K1 | K2 | K3 |
下列说法正确的是_______(填标号)。
A.K1=K2,v1<v2 B.K1<K3,v1< v3 C.v2>v3,c2>2c3 D.c2+c3<3c1
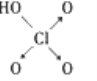
【题目】硫酰氯(SO2Cl2)和亚硫酰氯(SOCl2)常用作氯化剂,都可用于医药、农药、染料工业及有机合成工业。亚硫酰氯还用于制锂亚硫酰氯(Li/SOCl2)电池。
有关物质的部分性质如下表:
物质 | 熔点/℃ | 沸点/℃ | 其它性质 |
SO2Cl2 | -54.1 | 69.1 | ①易水解,产生大量白雾 ②易分解:SO2Cl2 |
H2SO4 | 10.4 | 338 | 具有吸水性且难分解 |
实验室用干燥而纯净的二氧化硫和氯气合成硫酰氯,反应的热化学方程式为:SO2(g)+Cl2(g) ![]() SO2Cl2(l) △H= - 97.3 kJ·mol-1。反应装置如图所示(夹持仪器已省略),请回答有关问题:
SO2Cl2(l) △H= - 97.3 kJ·mol-1。反应装置如图所示(夹持仪器已省略),请回答有关问题:

(1)仪器A的名称为___________;
(2)仪器B的作用是_____________________;
(3)装置丙中盛放的试剂为____________,在实验室用氢氧化钠吸收多余硫酰氯反应的离子方程式为___________________;
(4)为提高本实验中硫酰氯的产率,在实验操作中需要注意的事项有_________(填序号)
①先通冷凝水,再通气体 ②控制气流速率,宜慢不宜快
③若三颈烧瓶发烫,可适当降温 ④加热三颈烧瓶
(5)少量硫酰氯也可用氯磺酸(ClSO3H)分解获得,该反应的化学方程式为:2ClSO3H=H2SO4+SO2Cl2,此方法得到的产品中会混有硫酸。
①从分解产物中分离出硫酰氯的实验操作名称为__________________,
②设计实验方案检验氯磺酸分解制取硫酰氯产品中混有硫酸,下列方案合理的是:_____(填字母)
A.取样品溶于水,滴加紫色石蕊溶液变红:再取少量溶液,加入BaCl2溶液产生白色沉淀,说明含有H2SO4。
B.取样品在干燥条件下加热至完全反应,冷却后直接加BaCl2溶液,有白色沉淀,再滴加紫色石蕊溶液变红,说明含有H2SO4。
(6)Li—SOCl2电池可用于心脏起搏器。该电池的电极材料分别为锂和碳,电解质溶液是LiAlCl4—SOCl2。电池的总反应可表示为:4Li+2SOCl2===4LiCl+S+SO2。
①写出该电池正极发生的电极反应式_______________________________
②组装该电池必须在无水、无氧的条件下进行,原因是__________________