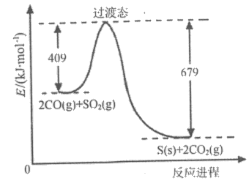
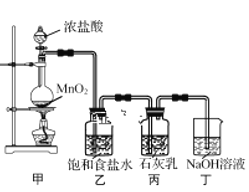
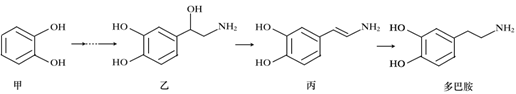
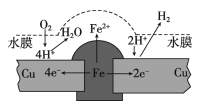
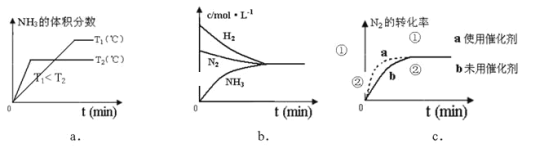
题目内容
【题目】请按要求用合适的化学用语填空
(1)基态P原子的电子排布式:______________
(2)Fe3+ 外围电子排布图:_______________
(3)用电子式表示MgCl2的形成过程:_______
(4)用水解方程式表示明矾能净水的原因:_______
【答案】1s22s22p63s23p3 
![]() Al3++3H2OAl(OH)3+3H+
Al3++3H2OAl(OH)3+3H+
【解析】
(1)P为15号元素;
(2)Fe为26号元素,形成离子时失去最外层电子;
(3)MgCl2为离子化合物,根据离子化合物的电子式表示方法写出硫化钠的形成过程;
(4)明矾溶于水产生铝离子,铝离子水解生成氢氧化铝胶体可以净水。
(1)P元素为15号元素,原子核外有15个电子,所以核外电子排布式为:1s22s22p63s23p3,故答案为:1s22s22p63s23p3;
(2)Fe3+的外围电子排布为3d5,结合泡利原理、洪特规则画出排布图为 ,故答案为:
,故答案为: ;
;
(3)MgCl2为离子化合物,用电子式表示氯化镁的形成过程为:![]() ;故答案为:
;故答案为:![]() ;
;
(4)明矾净水是利用铝离子水解生成氢氧化铝胶体,Al3++3H2OAl(OH)3+3H+,生成的氢氧化铝胶体具有吸附作用,可以净水,故答案为:Al3++3H2OAl(OH)3+3H+。

【题目】I.已知25℃时,醋酸、碳酸、氢氰酸的电离平衡常数如下表:(单位省略)
醋酸 | 碳酸 | 氢氰酸 |
Ka=1.7×10 | Ka1=4.2×10 | Ka=6.2×10 |
(1)写出碳酸的第一步电离方程式__________________________________。
(2)25℃时,等浓度的三种溶液①NaCN 溶液、②Na2CO3溶液、③CH3COONa 溶液,pH由大到小的顺序为_____________________ (填序号)。
(3)25℃时,向NaCN溶液中通入少量CO2,反应的离子方程式为_______________。
(4)将浓度为0.02mol/L的HCN 与0.01mol/LNaOH 溶液等体积混合,测得混合溶液中c(Na+)>c(CN![]() ),下列关系正确的是_______。
),下列关系正确的是_______。
a.c(H+)>c(OH![]() ) b.c(H+)+c(HCN)=c(OH
) b.c(H+)+c(HCN)=c(OH![]() ) c.c(HCN)+c(CN
) c.c(HCN)+c(CN![]() )=0.01mol/L
)=0.01mol/L
II.请用有关电解质溶液的知识回答下列问题:
(1)某温度下纯水的c(H+)=4.0×10![]() mol/L,若温度不变,滴入稀盐酸,使c(H+)=2.0×10
mol/L,若温度不变,滴入稀盐酸,使c(H+)=2.0×10![]() mol/L,则此溶液中由水电离产生的c(H+)=_________。
mol/L,则此溶液中由水电离产生的c(H+)=_________。
(2)氢氧化铜悬浊液中存在如下平衡:Cu(OH)2(s) Cu2+(aq)+2OH-(aq),常温下其Ksp=c(Cu2+)·c2(OH-)=2×10![]() 。某硫酸铜溶液里c(Cu2+)=0.02 mol·L
。某硫酸铜溶液里c(Cu2+)=0.02 mol·L![]() ,如要生成Cu(OH)2沉淀,应调整溶液使之pH>________
,如要生成Cu(OH)2沉淀,应调整溶液使之pH>________
(3)向含有相同浓度Fe2+、Hg2+的溶液中滴加Na2S溶液,先生成______沉淀(填化学式)。在工业废水处理过程中,依据沉淀转化原理,可用FeS作为沉淀剂除去废水中的Hg2+,写出相应的离子方程式______________________。(Ksp(FeS)=6.3×10![]() ,Ksp(HgS)=6.4×10
,Ksp(HgS)=6.4×10![]() )
)