题目内容
【题目】对烟道气中![]() 进行回收再利用具有较高的社会价值和经济价值。
进行回收再利用具有较高的社会价值和经济价值。
I. ![]() 还原法
还原法

(1)一定条件下,由![]() 和
和![]() 反应生成
反应生成![]() 和
和![]() 的能量变化如图所示,每生成
的能量变化如图所示,每生成![]() ,该反应__________(填“放出”或“吸收”)的热量为____________。
,该反应__________(填“放出”或“吸收”)的热量为____________。
(2)在绝热恒容的密闭容器中,进行反应:![]() ,该反应的平衡常数表达式为_______________________,对此反应下列说法正确的是_________。
,该反应的平衡常数表达式为_______________________,对此反应下列说法正确的是_________。
a.若混合气体密度保持不变,则已达平衡状态
b.从反应开始到平衡,容器内气体的压强保持不变
c.达平衡后若再充入一定量![]() ,平衡常数保持不变
,平衡常数保持不变
d.分离出![]() ,正、逆反应速率均保持不变
,正、逆反应速率均保持不变
(3)向![]() 恒温恒容密闭容器中通入
恒温恒容密闭容器中通入![]()
![]() 和
和![]()
![]() ,分别进行
,分别进行![]() 三组实验。在不同条件下发生反应:
三组实验。在不同条件下发生反应:![]() ,反应体系总压强随时间的变化曲线如图所示,则三组实验温度的大小关系是
,反应体系总压强随时间的变化曲线如图所示,则三组实验温度的大小关系是![]() ______
______![]() ______
______![]() (填“
(填“![]() ”、“
”、“![]() ”或“
”或“![]() ”);实验
”);实验![]() 从反应开始至平衡时,反应速率
从反应开始至平衡时,反应速率![]() ______________。
______________。

II.![]() 溶液吸收法
溶液吸收法
常温下,用![]() 溶液吸收
溶液吸收![]() 的过程中,溶液
的过程中,溶液![]() 随吸收
随吸收![]() 物质的量的变化曲线如图所示。
物质的量的变化曲线如图所示。

(4)常温下,![]() 的二级电离平衡常数
的二级电离平衡常数![]() 的数值为_________________。
的数值为_________________。
【答案】放出 135kJ K=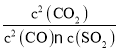 ad = < 6.25×10-3mol/(Lmin); 10-7.3
ad = < 6.25×10-3mol/(Lmin); 10-7.3
【解析】
(1)根据图象分析,反应物总能量高于生成物总能量,则反应为放热反应,正、逆反应活化能之差为反应放出的热量;
(2)气相为主的反应中,固体物质的浓度不变,根据平衡常数含义列出平衡常数表达式,结合常用判断化学平衡的方法判断化学反应是否达到平衡,据此逐项分析;
(3)反应为放热反应,反应前后气体物质的量减小,体系压强减小,体系a和体系b反应起始时和平衡时的压强都相等,则二者平衡常数相同,对于一定质量的气体来说,![]() 等于衡量,据此分析b和c的体系温度高低,根据化学反应速率定义计算SO2的平均反应速率;
等于衡量,据此分析b和c的体系温度高低,根据化学反应速率定义计算SO2的平均反应速率;
(4)H2SO3的一级电离平衡为:H2SO3![]() H++HSO3-,二级电离平衡为:HSO3-
H++HSO3-,二级电离平衡为:HSO3-![]() H++SO32-,根据Na2SO3溶液吸收SO2的过程中,溶液pH随吸收SO2物质的量的变化曲线计算H2SO3的二级电离平衡常数。
H++SO32-,根据Na2SO3溶液吸收SO2的过程中,溶液pH随吸收SO2物质的量的变化曲线计算H2SO3的二级电离平衡常数。
(1)根据图象分析,反应物的总能量比生成物总能量高,反应发生时多余的能量会释放出来,因此该反应的正反应为放热反应,正、逆反应的活化能之差为反应放出的热量,活化能的差值为270kJ/mol,由于反应产生的S质量为16g,其物质的量为16g÷32g/mol=0.5mol,所以反应放出的热量为:270kJ/mol×0.5mol=135kJ;
(2)根据平衡常数的含义,可知该反应的平衡常数表达式为K= 。
。
a.混合气体密度为ρ=![]() ,恒容容器容积V不变,反应前后气体的质量发生改变,则当反应到达平衡时,气体总质量m不变,因此若混合气体密度不变,说明反应已经达到平衡状态,a正确;
,恒容容器容积V不变,反应前后气体的质量发生改变,则当反应到达平衡时,气体总质量m不变,因此若混合气体密度不变,说明反应已经达到平衡状态,a正确;
b.反应达到平衡前后,气体总物质的量发生改变,体系压强改变,b错误;
c.达平衡后若再充入一定量CO2,使化学平衡逆向移动,由于反应在绝热容器中进行,反应逆向移动会产生热量变化,导致体系温度发生改变,化学平衡常数改变,c错误;
d.分离出S,由于S是固体,浓度不变,因此改变其物质的量,不影响化学平衡,因此正、逆反应速率均保持不变,d正确;
故合理选项是ad;
(3)体系a和体系b反应起始时和平衡时的压强都相等,则二者平衡常数相同,体系a和体系b的温度相等,根据![]() 等于衡量,可知初始时刻压强c>b,则实验温度c>b,因此三组实验温度的关系是a=b<c;实验a从反应开始至平衡时,压强由160kPa改变至120kPa,设反应过程转化了xmolSO2,由
等于衡量,可知初始时刻压强c>b,则实验温度c>b,因此三组实验温度的关系是a=b<c;实验a从反应开始至平衡时,压强由160kPa改变至120kPa,设反应过程转化了xmolSO2,由![]() 等于衡量可知,气体的压强与气体的体积(即总物质的量)成正比,所以有
等于衡量可知,气体的压强与气体的体积(即总物质的量)成正比,所以有![]() ,,解得x=0.75mol,则反应速率v(SO2)=
,,解得x=0.75mol,则反应速率v(SO2)=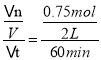 =6.25×10-3mol/(Lmin);
=6.25×10-3mol/(Lmin);
(4)H2SO3的一级电离平衡为:H2SO3![]() H++HSO3-,二级电离平衡为:HSO3-
H++HSO3-,二级电离平衡为:HSO3-![]() H++SO32-,根据Na2SO3溶液吸收SO2的过程中,溶液pH随吸收SO2物质的量的变化曲线分析,H2SO3的二级电离平衡和SO32-的一级水解平衡相关,未通入SO2时,Na2SO3溶液的pH为10.6,则溶液中c(OH-)=10-3.4mol/L,忽略SO32-的二级水解,则溶液中c(HSO3-)=c(OH-)=10-3.4mol/L
H++SO32-,根据Na2SO3溶液吸收SO2的过程中,溶液pH随吸收SO2物质的量的变化曲线分析,H2SO3的二级电离平衡和SO32-的一级水解平衡相关,未通入SO2时,Na2SO3溶液的pH为10.6,则溶液中c(OH-)=10-3.4mol/L,忽略SO32-的二级水解,则溶液中c(HSO3-)=c(OH-)=10-3.4mol/L =10-6.7,H2SO3的二级电离平衡常数Ka2=
=10-6.7,H2SO3的二级电离平衡常数Ka2=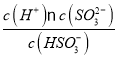 =
=![]() =10-7.3。
=10-7.3。

 阅读快车系列答案
阅读快车系列答案


