题目内容
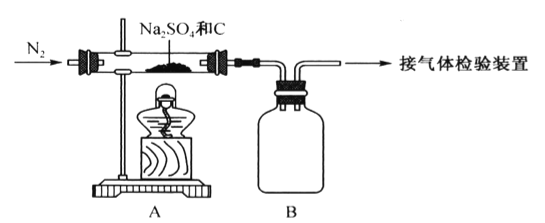
【题目】某学校化学学习小组为探究二氧化氮的性质,按如图所示装置进行实验。
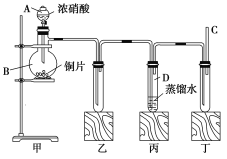
回答下列问题:
(1)装置甲中盛放浓硝酸的仪器A的名称是_____,该装置中发生反应的化学方程式为___。
(2)实验过程中,装置乙、丙中出现的现象分别是__________、____________;装置丙中的试管内发生反应的离子方程式为________________(不是离子反应的不写)。
(3)取下装置丙中的试管D,在其中滴加FeSO4溶液,溶液变为________色,为了证明铁元素在该反应中的产物,可以再向溶液中滴加KSCN溶液,溶液变为________色。
【答案】分液漏斗Cu+4HNO3(浓)===Cu(NO3)2+2NO2↑+2H2O生成红棕色气体蒸馏水中有气泡产生,生成的气体在试管上方变为红棕色3NO2+H2O===2H++2NO3-+NO黄红
【解析】
(1)装置甲中盛放浓硝酸的仪器A的名称是分液漏斗;烧瓶中发生浓硝酸与铜片的氧化还原反应,化学方程式为Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O;
(2)铜和浓硝酸在装置甲中反应Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O,生成红棕色的二氧化氮气体进入乙装置,所以装置乙中出现的现象为生成红棕色气体;二氧化氮经导管进入丙装置和水反应3NO2+H2O=2H++2NO3-+NO,NO又与试管上方的空气反应生成红棕色二氧化氮,所以装置丙中出现的现象是蒸馏水中有气泡产生,生成无色气体在试管上方变为红棕色;
(3)丙装置中的液体为二氧化氮和水反应生成的硝酸,硝酸具有氧化性,硫酸亚铁具有还原性,两者发生氧化还原反应4H++NO3-+3Fe2+=NO↑+2H2O+3Fe3+,因此溶液变为黄色。铁离子和硫氰根离子反应Fe3++3SCN-=Fe(SCN)3,生成血红色的络合物,可证明三价铁离子的生成。