МвДҝДЪИЭ
ЎҫМвДҝЎҝNH3ҫӯТ»ПөБР·ҙУҰҝЙТФөГөҪHNO3әНNH4NO3Ј¬ИзПВНјЛщКҫЎЈ

ЈЁ1Ј©ўсЦРЈ¬NH3әНO2ФЪҙЯ»ҜјБЧчУГПВ·ҙУҰЈ¬Жд»ҜС§·ҪіМКҪКЗ______________ЎЈ
ЈЁ2Ј©ўтЦРЈ¬2NO(g)Ј«O2(g)![]() 2NO2(g)ЎЈФЪЖдЛыМхјюПа
2NO2(g)ЎЈФЪЖдЛыМхјюПа
Н¬КұЈ¬·ЦұрІвөГNOөДЖҪәвЧӘ»ҜВКФЪІ»Н¬С№Зҝ(p1Ўўp2)ПВЛжОВ¶Иұд»ҜөДЗъПЯ(ИзНј)ЎЈ

ўЩұИҪПp1Ўўp2өДҙуРЎ№ШПөЈәp1________p2ЈЁМоЎ°<ЎұЈ¬Ў°>Ўұ»тЎ°=ЎұЈ©
ўЪЛжОВ¶ИЙэёЯЈ¬ёГ·ҙУҰЖҪәвіЈКэұд»ҜөДЗчКЖКЗ________ЈЁМоЎ°ФцҙуЎұЈ¬Ў°јхРЎЎұ»тЎ°І»ұдЎұЈ©ЎЈ
ЈЁ3Ј©ўуЦРЈ¬ҪөөНОВ¶ИЈ¬Ҫ«NO2(g)ЧӘ»ҜОӘN2O4(l)Ј¬ФЩЦЖұёЕЁПхЛбЎЈ
ўЩТСЦӘЈә2NO2(g)![]() N2O4(g) ҰӨH12NO2(g)
N2O4(g) ҰӨH12NO2(g)![]() N2O4(l) ҰӨH2
N2O4(l) ҰӨH2
ПВБРДЬБҝұд»ҜКҫТвНјЦРЈ¬ХэИ·өДКЗ(СЎМоЧЦДё)________ЎЈ

ўЪN2O4УлO2ЎўH2O»ҜәПөД»ҜС§·ҪіМКҪКЗ____________________ЎЈ

ЈЁ4Ј©ўфЦРЈ¬өзҪвNOЦЖұёNH4NO3Ј¬Жд№ӨЧчФӯАнИзНјЛщКҫЎЈОӘК№өзҪвІъОпИ«ІҝЧӘ»ҜОӘNH4NO3Ј¬РиІ№ідAЎЈAКЗ______Ј¬ЛөГчАнУЙЈә__________________________ЎЈ
Ўҫҙр°ёЎҝЈЁ1Ј©4NH3Ј«5O2![]() 4NOЈ«6H2O
4NOЈ«6H2O
ЈЁ2Ј©ўЩЈј ўЪјхРЎ
ЈЁ3Ј©ўЩA ўЪ2N2O4Ј«O2Ј«2H2O="==" 4HNO3
ЈЁ4Ј©NH3ёщҫЭ·ҙУҰЈә8NOЈ«7H2O![]() 3NH4NO3Ј«2HNO3Ј¬өзҪвІъЙъөДHNO3¶а
3NH4NO3Ј«2HNO3Ј¬өзҪвІъЙъөДHNO3¶а
ЎҫҪвОцЎҝКФМв·ЦОцЈәЈЁ1Ј©°ұЖшәНСхЖшФЪҙЯ»ҜјБЧчУГПВ·ўСх»Ҝ»№Фӯ·ҙУҰЈ¬ЙъіЙNOәНЛ®Ј¬»ҜС§·ҪіМОӘ4NH3+5O2![]() 4NO+6H2OЈ»
4NO+6H2OЈ»
ЈЁ2Ј©ўЩёГ·ҙУҰөДХэ·ҙУҰОӘЖшМеОпЦКөДБҝјхРЎөД·ҙУҰЈ¬ЖдЛыМхјюІ»ұдКұЈ¬ФцҙуС№ЗҝЈ¬ЖҪәвПтЖшМеОпЦКөДБҝјхРЎөД·ҪПтТЖ¶ҜЈ¬јҙПтХэ·ҙУҰ·ҪПтТЖ¶ҜЈ¬јҙС№ЗҝФҪёЯЈ¬NOөДЖҪәвЧӘ»ҜВКФҪҙуЈ¬ёщҫЭНјКҫЦӘЈ¬ПаН¬ОВ¶ИПВЈ¬С№ЗҝP1КұNOөДЧӘ»ҜВКЈјP2КұNOөДЧӘ»ҜВКЈ¬№КP1ЈјP2Ј»
ўЪЖдЛыМхјюІ»ұдКұЈ¬ЙэёЯОВ¶ИЈ¬ЖҪәвПтЧЕОьИИ·ҙУҰ·ҪПтТЖ¶ҜЈ¬УЦёщҫЭНјКҫЦӘЈ¬ПаН¬С№ЗҝПВЈ¬ЛжЧЕОВ¶ИөДЙэёЯЈ¬NOөДЧӘ»ҜВКҪөөНЈ¬јҙЙэёЯОВ¶ИЈ¬ЖҪәвПтДж·ҙУҰ·ҪПтТЖ¶ҜЈ¬№КДж·ҙУҰ·ҪПтОӘОьИИ·ҙУҰЈ¬ФтХэ·ҙУҰ·ҪПтКЗ·ЕИИ·ҙУҰЈ¬ФтЛжЧЕОВ¶ИөДЙэёЯЈ¬ёГ·ҙУҰөДЖҪәвіЈКэјхРЎЈ»
ЈЁ3Ј©ўЩ
2NO2(g)![]() N2O4(g) ҰӨH1ўЩ
N2O4(g) ҰӨH1ўЩ
2NO2(g)![]() N2O4(l) ҰӨH2 ўЪ ёщҫЭёЗЛ№¶ЁВЙЈәўЩ-ўЪөГ
N2O4(l) ҰӨH2 ўЪ ёщҫЭёЗЛ№¶ЁВЙЈәўЩ-ўЪөГ
N2O4ЈЁgЈ©![]() N2O4ЈЁlЈ© ЎчH3=ЎчH1-ЎчH2Ј¬Т»°гАҙЛөЈ¬ОпЦКУЙЖшМ¬ұдОӘТәМ¬Ј¬·ЕіцИИБҝЈ¬јҙЎчH3=ЎчH1-ЎчH2Јј0Ј¬јҙЎчH1ЈҫЎчH2Ј¬УЙҪөөНОВ¶ИЈ¬Ҫ«NO2ЧӘ»ҜОӘN2O4Ј¬ҝЙЦӘёГ·ҙУҰОӘ·ЕИИ·ҙУҰЈ¬јҙ0ЈҫЎчH1ЈҫЎчH2Ј¬јҙ·ҙУҰОп2NO2ЈЁgЈ©өДЧЬДЬБҝҙуУЪЙъіЙОпN2O4ЈЁgЈ©әНN2O4ЈЁlЈ©өДЧЬДЬБҝЈ¬ЗТЗ°ХЯ·ЕіцөДИИБҝРЎЈ¬№Кҙр°ёОӘAЈ»
N2O4ЈЁlЈ© ЎчH3=ЎчH1-ЎчH2Ј¬Т»°гАҙЛөЈ¬ОпЦКУЙЖшМ¬ұдОӘТәМ¬Ј¬·ЕіцИИБҝЈ¬јҙЎчH3=ЎчH1-ЎчH2Јј0Ј¬јҙЎчH1ЈҫЎчH2Ј¬УЙҪөөНОВ¶ИЈ¬Ҫ«NO2ЧӘ»ҜОӘN2O4Ј¬ҝЙЦӘёГ·ҙУҰОӘ·ЕИИ·ҙУҰЈ¬јҙ0ЈҫЎчH1ЈҫЎчH2Ј¬јҙ·ҙУҰОп2NO2ЈЁgЈ©өДЧЬДЬБҝҙуУЪЙъіЙОпN2O4ЈЁgЈ©әНN2O4ЈЁlЈ©өДЧЬДЬБҝЈ¬ЗТЗ°ХЯ·ЕіцөДИИБҝРЎЈ¬№Кҙр°ёОӘAЈ»
ўЪN2O4УлСхЖшЎўЛ®·ҙУҰЙъіЙПхЛбЈ¬»ҜС§·ҪіМКҪОӘЈә2N2O4+O2+2H2O=4HNO3Ј»
ЈЁ4Ј©өзҪвNOЦЖұёПхЛбп§Ј¬Сфј«·ҙУҰОӘЈәNO-3e-+2H2O=NO3-+4H+Ј¬Тхј«·ҙУҰОӘЈәNO+5e-+6H+=NH4++H2OЈ¬ҙУБҪј«·ҙУҰҝЙҝҙіцИфТӘК№өзЧУөГК§КШәгЈ¬Сфј«ІъЙъөДNO3-өДБҝҙуУЪТхј«ІъЙъөДNH4+өДБҝЈ¬ЧЬ·ҙУҰОӘ8NO+7H2O![]() 3NH4NO3+2HNO3Ј¬№КУҰІ№ідККБҝөД°ұЖшЎЈ
3NH4NO3+2HNO3Ј¬№КУҰІ№ідККБҝөД°ұЖшЎЈ

ЎҫМвДҝЎҝПВұнБРіцБЛAЎ«RөИ9ЦЦФӘЛШФЪЦЬЖЪұнЦРөДО»ЦГЈ»
IA | ўтA | ўуA | ўфA | ўхA | ўцA | ўчA | 0 | |
2 | E | F | ||||||
3 | A | C | D | G | R | |||
4 | B | H |
ЈЁ1Ј©РҙіцПВБРФӘЛШөДГыіЖЈ»A Ј¬ C Ј¬ E Ј¬ R Ј®
ЈЁ2Ј©DөДФӯЧУҪб№№КҫТвНјОӘ Ј¬ ЖдЧоёЯјЫСх»ҜОпөДЛ®»ҜОпУлЗвСх»ҜДЖИЬТә·ҙУҰөДАлЧУ·ҪіМКҪКЗ Ј®
ЈЁ3Ј©AЎўBЎўCИэЦЦФӘЛШөДФӯЧУ°лҫ¶УЙҙуөҪРЎөДЛіРтОӘЈЁМоФӘЛШ·ыәЕЈ©Ј¬ЖдЧоёЯјЫСх»ҜОп¶ФУҰЛ®»ҜОпөДјоРФУЙЗҝөҪИхЛіРтОӘ Ј® ЈЁМо»ҜС§КҪЈ©
ЈЁ4Ј©FФӘЛШөДЗв»ҜОпөДөзЧУКҪОӘ Ј¬ ЖдЦРТ»ЦЦЗв»ҜОпФЪіЈОВПВУлMnO2»мәПөД·ҙУҰ»ҜС§·ҪіМКҪОӘ Ј®
ЈЁ5Ј©УГөзЧУКҪұнКҫAУлHРОіЙ»ҜәПОпөД№эіМОӘ Ј¬ ёЯОВЧЖЙЛёГ»ҜәПОпКұЈ¬»рСжіКЙ«Ј®
ЎҫМвДҝЎҝАыУГУТНјЧ°ЦГІв¶ЁЦРәНИИөДКөСйІҪЦиИзПВЈә 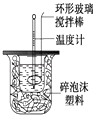
ўЩУГБҝНІБҝИЎ50mL 0.25mol/LБтЛбө№ИлРЎЙХұӯЦРЈ¬ІўІвіцЖдОВ¶ИЈ»
ўЪУГБнТ»БҝНІБҝИЎ50mL 0.55mol/L NaOHИЬТәЈ¬ІўІвіцЖдОВ¶ИЈ»
ўЫҪ«NaOHИЬТәө№ИлРЎЙХұӯЦРЈ¬Йи·ЁК№Ц®»мәПҫщФИЈ¬Івіц»мәПТәЧоёЯОВ¶ИЈ®
»ШҙрПВБРОКМвЈә
ЈЁ1Ј©РҙіцПЎБтЛбәНПЎЗвСх»ҜДЖИЬТә·ҙУҰөДЦРәНИИөДИИ»ҜС§·ҪіМКҪЈЁЦРәНИИКэЦөОӘ57.3kJ/molЈ©Јә Ј®
ЈЁ2Ј©ө№ИлNaOHИЬТәөДХэИ·ІЩЧчКЗ Ј®
A.СШІЈБ§°ф»әВэө№Ил
B.·ЦИэҙОЙЩБҝө№Ил
C.Т»ҙОСёЛЩө№Ил
ЈЁ3Ј©КөСйКэҫЭИзұнЈә
ўЩЗлМоРҙПВұнЦРөДҝХ°ЧЈә
ОВ¶И | ЖрКјОВ | ЦХЦ№ОВ¶Иt2/Ўж | ОВ¶ИІоЖҪҫщЦө | ||
H2SO4 | NaOH | ЖҪҫщЦө | |||
1 | 26.2 | 26.0 | 26.1 | 29.5 | |
3 | 25.9 | 25.9 | 25.9 | 29.2 | |
3 | 26.4 | 26.2 | 26.3 | 29.8 | |
ўЪҪьЛЖИПОӘ0.55mol/L NaOHИЬТәәН0.25mol/LБтЛбИЬТәөДГЬ¶И¶јКЗ1g/cm3 Ј¬ ЦРәНәуЙъіЙИЬТәөДұИИИИЭc=4.18J/ЈЁgЎжЈ©Ј®ФтЦРәНИИЎчH=ЈЁ ұЈБфТ»О»РЎКэЈ©Ј®