题目内容
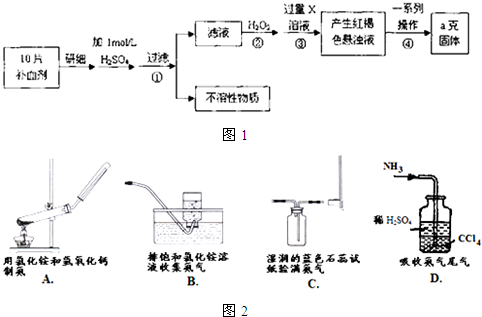
硫酸亚铁晶体(FeSO4?7H2O)在医药上常用作补血剂.某课外小组欲测定该补血剂中铁元素的含量.实验步骤如图1所示:
请回答下列问题:
(1)步骤②加入过量H2O2的目的是______;步骤③中的过量的X也可以改通入足量的NH3,反应的离子方程式:______.如图2所示有关NH3的实验室制取等问题描述正确的是______.(填选项)
(2)步骤④中一系列处理的操作步骤:过滤、______、灼烧、______、称量.若实验无损耗,则每片补血剂含铁元素的质量______ g(用含a的代数式表示,不用化简).
(3)该小组有些同学认为用KMnO4溶液滴定也能进行铁元素含量的测定(5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O).实验前,首先要精确配制一定物质的量浓度的KMnO4溶液250mL,配制时需要的仪器除天平、玻璃棒、烧杯、胶头滴管外,还需______.上述实验中的KMnO4溶液需要酸化,用于酸化的酸是______.
a.稀硝酸 b.稀硫酸 c.稀盐酸 d.浓硝酸.
解:(1)双氧水具有氧化性,酸性条件下能将Fe2+全部氧化为Fe3+,步骤③是将Fe3+转化为氢氧化铁沉淀,反应离子方程式为Fe3++3NH3?H2O=Fe(OH)3↓+3NH4+,
A.氯化铵和氢氧化钙反应生成氨气和水、氯化钙,反应中有水生成,为防止液化水蒸气倒流而炸裂试管,试管口要低于试管底,故A错误;
B.氨气极易溶于水,氨气的密度小于空气且和空气不反应,所以可以采用向下排空气法收集,故B错误;
C.氨气能使湿润的红色石蕊试纸变蓝,所以检验氨气要使用湿润的红色石蕊试纸,故C错误;
D.氨气有刺激性气味,所以最后要有尾气处理装置,氨气极易溶于水,为防止倒吸,尾气处理中要有缓冲装置,故D正确;
故答案为:将Fe2+全部氧化为Fe3+;Fe3++3NH3?H2O=Fe(OH)3↓+3NH4+;D;
(2)步骤④中一系列处理是由氢氧化铁悬浊液最终转化为氧化铁,需要过滤、洗涤的氢氧化铁,然后灼烧生成氧化铁,冷却后称量氧化铁的质量,ag氧化铁中铁的质量=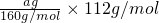 =
=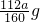 ,则每片补血剂含铁元素的质量为
,则每片补血剂含铁元素的质量为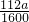 g,
g,
故答案为:洗涤,冷却,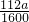 ;
;
(3)精确配制一定物质的量浓度的KMnO4溶液250mL,配制时需要的仪器除天平、玻棒、烧杯、胶头滴管,250mL容量瓶;高锰酸钾有强氧化性,能将盐酸氧化,硝酸具有氧化性,能亚铁离子氧化,故只能用稀硫酸酸化,
故答案为:250 mL容量瓶,b.
分析:由流程图可知,该实验原理为:将药品中的Fe2+形成溶液,将Fe2+氧化为Fe3+,使Fe3+转化为氢氧化铁沉淀,再转化为氧化铁,通过测定氧化铁的质量,计算补血剂中铁元素的含量.
(1)双氧水具有氧化性,酸性条件下能将Fe2+全部氧化为Fe3+,氨水和铁离子反应生成氢氧化铁红褐色沉淀;实验室用氯化铵和氢氧化钙制取氨气,用向下排空气法收集氨气,用湿润的红色石蕊试纸检验氨气,氨气有刺激性气味,所以最后要有尾气处理装置;
(2)步骤④中一系列处理是由氢氧化铁悬浊液最终转化为氧化铁,需要过滤、洗涤的氢氧化铁,然后灼烧生成氧化铁,冷却后称量氧化铁的质量;根据原子守恒计算铁的质量;
(3)精确配制一定物质的量浓度的KMnO4溶液250mL,配制时需要的仪器除天平、玻棒、烧杯、胶头滴管,250mL容量瓶;
加入的酸不能具有强氧化性,不能被酸性高锰酸钾氧化,防止影响酸性高锰酸钾溶液的体积,影响测定结果.
点评:本题考查学生对实验原理与实验操作的理解、物质分离提纯、元素化合物性质、氧化还原反应滴定、化学计算等,难度中等,清楚实验原理是解题的关键,注意(2)中计算的是每片补血剂中铁的质量而不是铁的总质量,为易错点.
A.氯化铵和氢氧化钙反应生成氨气和水、氯化钙,反应中有水生成,为防止液化水蒸气倒流而炸裂试管,试管口要低于试管底,故A错误;
B.氨气极易溶于水,氨气的密度小于空气且和空气不反应,所以可以采用向下排空气法收集,故B错误;
C.氨气能使湿润的红色石蕊试纸变蓝,所以检验氨气要使用湿润的红色石蕊试纸,故C错误;
D.氨气有刺激性气味,所以最后要有尾气处理装置,氨气极易溶于水,为防止倒吸,尾气处理中要有缓冲装置,故D正确;
故答案为:将Fe2+全部氧化为Fe3+;Fe3++3NH3?H2O=Fe(OH)3↓+3NH4+;D;
(2)步骤④中一系列处理是由氢氧化铁悬浊液最终转化为氧化铁,需要过滤、洗涤的氢氧化铁,然后灼烧生成氧化铁,冷却后称量氧化铁的质量,ag氧化铁中铁的质量=
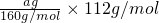 =
=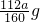 ,则每片补血剂含铁元素的质量为
,则每片补血剂含铁元素的质量为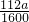 g,
g,故答案为:洗涤,冷却,
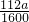 ;
;(3)精确配制一定物质的量浓度的KMnO4溶液250mL,配制时需要的仪器除天平、玻棒、烧杯、胶头滴管,250mL容量瓶;高锰酸钾有强氧化性,能将盐酸氧化,硝酸具有氧化性,能亚铁离子氧化,故只能用稀硫酸酸化,
故答案为:250 mL容量瓶,b.
分析:由流程图可知,该实验原理为:将药品中的Fe2+形成溶液,将Fe2+氧化为Fe3+,使Fe3+转化为氢氧化铁沉淀,再转化为氧化铁,通过测定氧化铁的质量,计算补血剂中铁元素的含量.
(1)双氧水具有氧化性,酸性条件下能将Fe2+全部氧化为Fe3+,氨水和铁离子反应生成氢氧化铁红褐色沉淀;实验室用氯化铵和氢氧化钙制取氨气,用向下排空气法收集氨气,用湿润的红色石蕊试纸检验氨气,氨气有刺激性气味,所以最后要有尾气处理装置;
(2)步骤④中一系列处理是由氢氧化铁悬浊液最终转化为氧化铁,需要过滤、洗涤的氢氧化铁,然后灼烧生成氧化铁,冷却后称量氧化铁的质量;根据原子守恒计算铁的质量;
(3)精确配制一定物质的量浓度的KMnO4溶液250mL,配制时需要的仪器除天平、玻棒、烧杯、胶头滴管,250mL容量瓶;
加入的酸不能具有强氧化性,不能被酸性高锰酸钾氧化,防止影响酸性高锰酸钾溶液的体积,影响测定结果.
点评:本题考查学生对实验原理与实验操作的理解、物质分离提纯、元素化合物性质、氧化还原反应滴定、化学计算等,难度中等,清楚实验原理是解题的关键,注意(2)中计算的是每片补血剂中铁的质量而不是铁的总质量,为易错点.

练习册系列答案
 一本好题口算题卡系列答案
一本好题口算题卡系列答案
相关题目
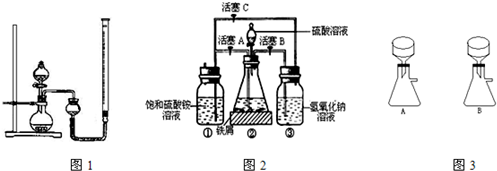
Ⅰ.某研究性学习小组用10g胆矾制取CuO,并证明CuO可以催化H2O2的分解反应.
(1)首先制备CuO,实验步骤如下,请完成缺少的步骤:
①称取10g胆矾,放入小烧杯中,再加水溶解;②向小烧杯中滴加NaOH溶液,至产生大量沉淀;③用酒精灯在石棉网上加热小烧杯,至沉淀物完全黑色;④将以上混合物过滤,洗涤,______,然后研细;⑤检查④中洗涤是否完全的操作是______.
(2)用图1所示,按表中设计实验方法,证明CuO能催化7%H2O2溶液的分解,并与MnO2的催化效果进行比较.
| 实验序号 | 双氧水体积 | 催化剂 | 待测数据 |
| a | 15mL | 无 | |
| b | 15mL | 0.5g CuO | |
| c | 15mL | 0.5g MnO2 |
②为探究CuO在实验b中是否起催化作用,除与
a比较外,还应补充以下实验(不必写具体操作):
A.证明CuO化学性质在反应前后是否改变;
B.______.
Ⅱ.摩尔盐[(NH4)2SO4?FeSO4?6H2O]
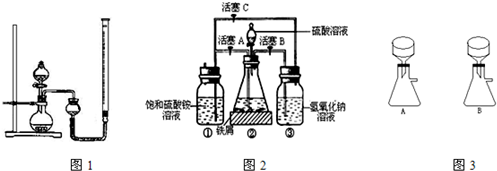
在空气中比一般亚铁盐稳定,是化学分析中常用的还原剂.某研究性学习小组用图2所示的实验装置来制取摩尔盐,实验步骤如下,回答下列问题:
(1)用30%的NaOH溶液和废铁屑(含少量油污、铁锈、FeS等)混合、煮沸、冷却、分离,将分离出的NaOH溶液装入③中.
(2)利用容器②的反应,向容器①中通入氢气,应关闭活塞______,打开活塞______(填字母).向容器①中通人氢气的目的是______.
(3)待锥形瓶中的铁屑快反应完时,关闭活塞B、C,打开活塞A,继续产生的氢气会将锥形瓶中的硫酸亚铁(含极少部分未反应的稀硫酸)压到饱和硫酸铵溶液的底部.在常温下放置一段时间,试剂瓶底部将结晶出硫酸亚铁铵,抽滤,制得硫酸亚铁铵晶体.图3是抽滤装置的一部分,其中正确的是______.(填A或B)
(4)为了确定产品中亚铁离子的含量,研究小组用滴定法来测定.若取产品24.50g配成100mL溶液,取出10.00mL用0.1000mol?L-1KMnO4酸性溶液滴定,消耗KMnO4溶液10.00mL.
已知高锰酸钾与Fe2+的离子方程式为:MnO
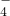 +5Fe2++8H+=Mn2++5Fe3++4H2O
+5Fe2++8H+=Mn2++5Fe3++4H2O试求产品中摩尔盐的质量分数______.(NH4)2SO4?FeSO4?6H2O的相对分子质量为392.
Ⅰ.某研究性学习小组用10g胆矾制取CuO,并证明CuO可以催化H2O2的分解反应.
(1)首先制备CuO,实验步骤如下,请完成缺少的步骤:
①称取10g胆矾,放入小烧杯中,再加水溶解;②向小烧杯中滴加NaOH溶液,至产生大量沉淀;③用酒精灯在石棉网上加热小烧杯,至沉淀物完全黑色;④将以上混合物过滤,洗涤, ,然后研细;⑤检查④中洗涤是否完全的操作是 .
(2)用图1所示,按表中设计实验方法,证明CuO能催化7%H2O2溶液的分解,并与MnO2的催化效果进行比较.
①从设计原理看,实验中的待测数据是 .
②为探究CuO在实验b中是否起催化作用,除与
a比较外,还应补充以下实验(不必写具体操作):
A.证明CuO化学性质在反应前后是否改变;
B. .
Ⅱ.摩尔盐[(NH4)2SO4?FeSO4?6H2O]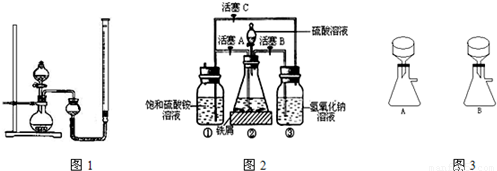
在空气中比一般亚铁盐稳定,是化学分析中常用的还原剂.某研究性学习小组用图2所示的实验装置来制取摩尔盐,实验步骤如下,回答下列问题:
(1)用30%的NaOH溶液和废铁屑(含少量油污、铁锈、FeS等)混合、煮沸、冷却、分离,将分离出的NaOH溶液装入③中.
(2)利用容器②的反应,向容器①中通入氢气,应关闭活塞 ,打开活塞 (填字母).向容器①中通入氢气的目的是 .
(3)待锥形瓶中的铁屑快反应完时,关闭活塞B、C,打开活塞A,继续产生的氢气会将锥形瓶中的硫酸亚铁(含极少部分未反应的稀硫酸)压到饱和硫酸铵溶液的底部.在常温下放置一段时间,试剂瓶底部将结晶出硫酸亚铁铵,抽滤,制得硫酸亚铁铵晶体.图3是抽滤装置的一部分,其中正确的是 .(填A或B)
(4)为了确定产品中亚铁离子的含量,研究小组用滴定法来测定.若取产品24.50g配成100mL溶液,取出10.00mL用0.1000mol?L-1KMnO4酸性溶液滴定,消耗KMnO4溶液10.00mL.
已知高锰酸钾与Fe2+的离子方程式为:MnO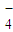 +5Fe2++8H+=Mn2++5Fe3++4H2O
+5Fe2++8H+=Mn2++5Fe3++4H2O
试求产品中摩尔盐的质量分数 .(NH4)2SO4?FeSO4?6H2O的相对分子质量为392.
(1)首先制备CuO,实验步骤如下,请完成缺少的步骤:
①称取10g胆矾,放入小烧杯中,再加水溶解;②向小烧杯中滴加NaOH溶液,至产生大量沉淀;③用酒精灯在石棉网上加热小烧杯,至沉淀物完全黑色;④将以上混合物过滤,洗涤, ,然后研细;⑤检查④中洗涤是否完全的操作是 .
(2)用图1所示,按表中设计实验方法,证明CuO能催化7%H2O2溶液的分解,并与MnO2的催化效果进行比较.
| 实验序号 | 双氧水体积 | 催化剂 | 待测数据 |
| a | 15mL | 无 | |
| b | 15mL | 0.5g CuO | |
| c | 15mL | 0.5g MnO2 |
②为探究CuO在实验b中是否起催化作用,除与
a比较外,还应补充以下实验(不必写具体操作):
A.证明CuO化学性质在反应前后是否改变;
B. .
Ⅱ.摩尔盐[(NH4)2SO4?FeSO4?6H2O]

在空气中比一般亚铁盐稳定,是化学分析中常用的还原剂.某研究性学习小组用图2所示的实验装置来制取摩尔盐,实验步骤如下,回答下列问题:
(1)用30%的NaOH溶液和废铁屑(含少量油污、铁锈、FeS等)混合、煮沸、冷却、分离,将分离出的NaOH溶液装入③中.
(2)利用容器②的反应,向容器①中通入氢气,应关闭活塞 ,打开活塞 (填字母).向容器①中通入氢气的目的是 .
(3)待锥形瓶中的铁屑快反应完时,关闭活塞B、C,打开活塞A,继续产生的氢气会将锥形瓶中的硫酸亚铁(含极少部分未反应的稀硫酸)压到饱和硫酸铵溶液的底部.在常温下放置一段时间,试剂瓶底部将结晶出硫酸亚铁铵,抽滤,制得硫酸亚铁铵晶体.图3是抽滤装置的一部分,其中正确的是 .(填A或B)
(4)为了确定产品中亚铁离子的含量,研究小组用滴定法来测定.若取产品24.50g配成100mL溶液,取出10.00mL用0.1000mol?L-1KMnO4酸性溶液滴定,消耗KMnO4溶液10.00mL.
已知高锰酸钾与Fe2+的离子方程式为:MnO
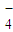 +5Fe2++8H+=Mn2++5Fe3++4H2O
+5Fe2++8H+=Mn2++5Fe3++4H2O试求产品中摩尔盐的质量分数 .(NH4)2SO4?FeSO4?6H2O的相对分子质量为392.