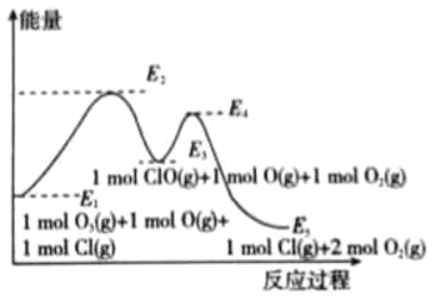
题目内容
【题目】25℃时,下列各组离子在指定溶液中一定能大量共存的是( )
A.能使甲基橙变红的溶液中:K+、Mg2+、NO3-、I-
B.c(HCO3-)=1 mol·L-1溶液中:Na+、Al3+、SO42-、Cl-
C.无色透明的溶液中:Fe3+、Al3+、NO3-、SO42-
D.常温下,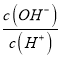 =10-10的溶液中:K+、Na+、I-、SO42-
=10-10的溶液中:K+、Na+、I-、SO42-
【答案】D
【解析】
离子若不能发生任何反应,且与题干选项要求不产生影响,就可以大量共存,否则不能大量存在。
A.能使甲基橙变红的溶液显酸性,含有大量的H+,H+、NO3-、I-会发生氧化还原反应,不能大量共存,A错误;
B.c(HCO3-)=1 mol·L-1溶液中:HCO3-、Al3+会发生双水解反应生成Al(OH)3沉淀和CO2气体,不能大量共存,B错误;
C.无色透明的溶液中不能含有大量的Fe3+,含有铁离子的溶液呈黄色,C错误;
D.常温下,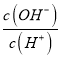 =10-10的溶液显酸性,含有大量的H+,H+与选项中K+、Na+、I-、SO42-均不发生任何反应,可以大量共存,D正确;
=10-10的溶液显酸性,含有大量的H+,H+与选项中K+、Na+、I-、SO42-均不发生任何反应,可以大量共存,D正确;
故合理选项是D。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】(1)计算调控值:
室温下,当溶液中c(Mg2+)=c(Cu2+)=0.1mol·L-1时,Mg2+、Cu2+开始沉淀至沉淀完全的pH范围分别为__。已知:Ksp[Mg(OH)2]=10-9、Ksp[Cu(OH)2]=10-15,当c(Mg2+)≤1×10-5mol·L-1时视为沉淀完全。
(2)选择调控值
铝灰的回收利用方法很多,现用含有Al2O3、SiO2和少量FeO·xFe2O3的铝灰制备Al2(SO4)3·18H2O,工艺流程如下:
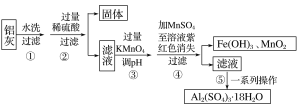
已知步骤③中所得溶液生成氢氧化物沉淀的pH如表所示:
Al(OH)3 | Fe(OH)2 | Fe(OH)3 | |
开始沉淀时的pH | 3.4 | 6.3 | 1.5 |
完全沉淀时的pH | 4.7 | 8.3 | 2.8 |
在该浓度下除去铁的化合物,调节pH的最大范围为___。
(3)如何调控
接问题(2),步骤③中调pH时最佳试剂为___。
(4)突破应用
为分析某铜合金的成分,用酸将其完全溶解后,用NaOH溶液调节pH,当pH=3.4时开始出现沉淀,分别在pH为7.0、8.0时过滤沉淀。
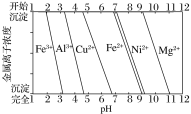
结合题图信息推断该合金中除铜外一定含有__。