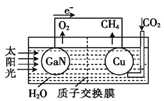
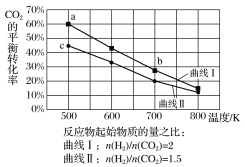
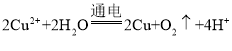题目内容
【题目】依据事实,回答下列问题。
(1)在 25℃、101 kPa 时,1.0 g C8H18(l,辛烷)燃烧生成CO2(g)和H2O(l),放出48.40kJ的热量,则C8H18(l)的燃烧热为_____kJ/mol
(2)已知N2(g)+2O2(g)=2NO2(g) ΔH=+67.7kJ/mol,N2H4(g)+O2(g)= N2(g)+2H2O (g) ΔH=-534kJ/mol,根据盖斯定律写出肼(N2H4)与 NO2完全反应生成氮气和气态水的热化学方程式____________。
(3)某反应过程中的能量变化如图所示,则该反应是___________反应(填“放热”或“吸热”),判断依据是____________________。

(4)已知:2NH3 (g)+3Cl2(g) =N2 (g) +6HCl(g) ΔH=–462 kJmol-1
N2(g)![]() 2N(g)
2N(g)
Cl2(g)![]() 2Cl(g)
2Cl(g)
则断开1 mol H–N键与断开1 mol H-Cl键所需能量相差约为_____kJ。
【答案】5517.6 2N2H4(g)+2NO2 (g) = 3N2(g)+4H2O(g) △H=-1135.7kJ/mol 吸热 反应物总能量小于生成物总能量 41
【解析】
(1)燃烧热限定可燃物为1mol,1mol 辛烷质量为114g,所以燃烧热应为48.40的114倍。
(2)首先写出方程式2N2H4(g)+2NO2(g) = 3N2(g)+4 H2O(g),再根据盖斯定律求算焓变。
(3)由反应物与生成物的能量大小,可确定反应是吸热还是放热。
(4)△H=反应物的总键能-生成物的总键能,代入数据即可求出断开 1 mol H–N键与断开1 mol H–Cl键所需能量的差值。
(1) 1mol 辛烷质量为 114g,所以燃烧热应为48.40kJ/mol×114=5517.6 kJ/mol。答案为:5517.6;
(2) N2(g)+2O2(g)=2NO2(g) ΔH=+67.7kJ/mol ①
N2H4(g)+O2(g)= N2(g)+2H2O (g) ΔH=-534kJ/mol ②
反应方程式为2N2H4(g)+2NO2(g) = 3N2(g)+4H2O(g),依据盖斯定律,将②×2-①,即得肼(N2H4)与NO2完全反应生成氮气和气态水的热化学方程式为2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g) △H=-1135.7kJ/mol。答案为:2N2H4(g)+2NO2(g) = 3N2(g)+4H2O(g) △H=-1135.7kJ/mol;
(3)由于反应物的总能量<生成物的总能量,所以反应吸热;判断依据是反应物总能量小于生成物总能量。答案为:吸热;反应物总能量小于生成物总能量;
(4) △H=反应物的总键能-生成物的总键能=6×E(N-H)+3×E(Cl-Cl)-E(N≡N)-6×E(H-Cl)= -462 kJmol-1,6×[E(N-H) –E(H-Cl)]=-246 kJmol-1,所以断开 1 mol H–N键与断开1 mol H–Cl 键所需能量相差约为41 kJ。答案为:41 kJ。

 全能测控期末小状元系列答案
全能测控期末小状元系列答案