题目内容
【题目】研究CO、CO2的回收利用既可变废为宝,又可减少碳的排放。回答下列问题:
(1)二甲醚(CH3OCH3)被誉为“21世纪的清洁燃料”,由CO和H2制备二甲醚的反应原理如下:
CO(g)+2H2(g)![]() CH3OH(g) ΔH=-90.1kJ/mol
CH3OH(g) ΔH=-90.1kJ/mol
2CH3OH(g)![]() CH3OCH3(g)+H2O(g) ΔH=-24.5kJ/mol
CH3OCH3(g)+H2O(g) ΔH=-24.5kJ/mol
已知:CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH=-41.0kJ/mol
CO2(g)+H2(g) ΔH=-41.0kJ/mol
则2CO2(g)+6H2(g)![]() CH3OCH3(g)+3H2O(g)的ΔH=__________,有利于提高该反应中CO2平衡转化率的条件是______(填标号)。
CH3OCH3(g)+3H2O(g)的ΔH=__________,有利于提高该反应中CO2平衡转化率的条件是______(填标号)。
A.高温低压 B.高温高压 C.低温低压 D.低温高压
(2)T1K时,将1mol二甲醚引入一个抽空的150L恒容容器中,发生分解反应: CH3OCH3(g)![]() CH4(g)+H2(g)+CO(g),在不同时间测定容器内的总压,所得数据见下表:
CH4(g)+H2(g)+CO(g),在不同时间测定容器内的总压,所得数据见下表:
反应时间t/min | 0 | 6.5 | 13.0 | 26.5 | 52.6 | ∞ |
气体总压p总/kPa | 50.0 | 55.0 | 65.0 | 83.2 | 103.8 | 125.0 |
①由表中数据计算:0~6.5min内的平均反应速率v(CH3OCH3)=_________,反应达平衡时,二甲醚的分解率为_______,该温度下平衡常数K=__________。
②若升高温度,CH3OCH3的浓度增大,则该反应为______反应(填“放热”或“吸热”),要缩短达到平衡的时间,可采取的措施有___________、__________。
(3)在T2K、1.0×104kPa下,等物质的量的CO与CH4混合气体发生如下反应: CO(g)+CH4(g)![]() CH3CHO(g),反应速率v=v正v逆=k正p(CO)·p(CH4)-k逆p(CH3CHO),k正、k逆分别为正、逆向反应速率常数,p为气体的分压(气体分压p=气体总压p总×体积分数)。用气体分压表示的平衡常数Kp=4.5×10-5(kPa)-1,则CO转化率为20%时
CH3CHO(g),反应速率v=v正v逆=k正p(CO)·p(CH4)-k逆p(CH3CHO),k正、k逆分别为正、逆向反应速率常数,p为气体的分压(气体分压p=气体总压p总×体积分数)。用气体分压表示的平衡常数Kp=4.5×10-5(kPa)-1,则CO转化率为20%时![]() =_______。
=_______。
【答案】-122.7kJ/mol D 5.13×10-5mol/(L·min) 75% 7.5×10-5(mol/L)2 放热 改进催化剂 增大反应物浓度 4:5
【解析】
(1)根据已知热化学方程式推导所求反应,再由盖斯定律计算2CO2(g)+6H2(g)![]() CH3OCH3(g)+3H2O(g)的焓变△H;该反应正向是体积减小的放热反应,改变条件使反应正向进行,可提高反应中CO2平衡转化率;
CH3OCH3(g)+3H2O(g)的焓变△H;该反应正向是体积减小的放热反应,改变条件使反应正向进行,可提高反应中CO2平衡转化率;
(2)①根据恒温恒容条件下,气体的物质的量之比等于压强之比计算混合气体的物质的量,结合三段式计算0~6.5min内和t=∞时各物质的浓度,利用速率公式和平衡常数k表达式计算;
②根据化学平衡移动的影响因素判断反应移动情况,根据化学反应速率影响因素说明提高反应速率的措施;
(3)先通过反应达到平衡时v正=v逆推导出平衡常数kp=![]() ,再利用三段式计算平衡气体分压p(CO)、p(CH4)、p(CH3CHO)计算v正、v逆的比。
,再利用三段式计算平衡气体分压p(CO)、p(CH4)、p(CH3CHO)计算v正、v逆的比。
(1)①CO(g)+2H2(g)![]() CH3OH(g) ΔH=-90.1kJ/mol
CH3OH(g) ΔH=-90.1kJ/mol
2CH3OH(g)![]() CH3OCH3(g)+H2O(g) ΔH=-24.5kJ/mol
CH3OCH3(g)+H2O(g) ΔH=-24.5kJ/mol
CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH=-41.0kJ/mol
CO2(g)+H2(g) ΔH=-41.0kJ/mol
由盖斯定律2×①+②-2×③有2CO2(g)+6H2(g)![]() CH3OCH3(g)+3H2O(g)的△H=2×(-90.1 kJ/mol)+(-24.5kJ/mol)-2×(-41.0 kJ/mol)= -122.7 kJ/mol;
CH3OCH3(g)+3H2O(g)的△H=2×(-90.1 kJ/mol)+(-24.5kJ/mol)-2×(-41.0 kJ/mol)= -122.7 kJ/mol;
2CO2(g)+6H2(g)![]() CH3OCH3(g)+3H2O(g)的△H=-122.7 kJ/mol,即反应正向是体积减小的放热反应,增大压强、降低温度、增大c(H2)、分离CH3OCH3等均可提高CO2平衡转化率,所以合理选项是D;
CH3OCH3(g)+3H2O(g)的△H=-122.7 kJ/mol,即反应正向是体积减小的放热反应,增大压强、降低温度、增大c(H2)、分离CH3OCH3等均可提高CO2平衡转化率,所以合理选项是D;
(2)①0~6.5 min内反应的三段式CH3OCH3(g)![]() CH4(g)+H2(g)+CO(g)
CH4(g)+H2(g)+CO(g)
起始量(mol) 1 0 0 0
变化量(mol) x x x x
最终量(mol) 1-x x x x
恒温恒容条件下,气体的物质的量之比等于压强之比,即(1+2x):1=55.0kPa:50kPa,解得x=0.05mol,0~6.5 min内的平均反应速率v(CH3OCH3)=![]() mol//(Lmin)
mol//(Lmin)
平衡时反应的三段式CH3OCH3(g)![]() CH4(g)+H2(g)+CO(g)
CH4(g)+H2(g)+CO(g)
起始量(mol) 1 0 0 0
变化量(mol) y y y y
最终量(mol) 1-y y y y
在恒温恒容条件下,气体的物质的量之比等于压强之比,即(1+2y):1=125.0kPa:50kPa,y=0.75mol,反应达平衡时,二甲醚的分解率=![]() ×100=75%,c(CH3OCH3)=
×100=75%,c(CH3OCH3)=![]() =
=![]() mol/L; c(CH4)=c(H2)=c(CO)=
mol/L; c(CH4)=c(H2)=c(CO)=![]() mol/L;平衡常数K=
mol/L;平衡常数K=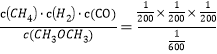 =7.5×10-5;
=7.5×10-5;
②升高温度,CH3OCH3的浓度增大,说明升高温度,化学平衡向逆反应方向移动,所以该反应的正反应是放热反应。缩短达到平衡的时间,即加快反应速率,加快反应速率的方法有:改进催化剂,增大反应物浓度、增大压强、升高温度等。
(3)当反应达到平衡时v正=v逆,则![]() =kp=4.5×10-5(kPa-1) ;
=kp=4.5×10-5(kPa-1) ;
T2 K、1.0×104 kPa时,设起始时n(CH4)=n(CO)=1mol,则
反应的三段式为CO(g)+CH4(g)![]() CH3CHO(g)
CH3CHO(g)
起始量(mol) 1 1 0
变化量(mol) 0.2 0.2 0.2
最终量(mol) 0.8 0.8 0.2
所以p(CH4)=p(CO)=![]() ×1.0×104 kPa=
×1.0×104 kPa=![]() ×1.0×104 kPa,p(CH3CHO)=
×1.0×104 kPa,p(CH3CHO)=![]() ×1.0×104 kPa=
×1.0×104 kPa=![]() ×1.0×104 kPa,所以v正═k正p(CH4)p(CO),v逆=k逆p(CH3CHO),
×1.0×104 kPa,所以v正═k正p(CH4)p(CO),v逆=k逆p(CH3CHO),![]() =4.5×10-5(kPa)-1
=4.5×10-5(kPa)-1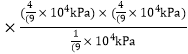 =
=![]() 。
。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案


