题目内容
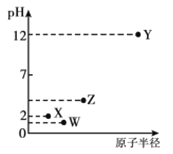
【题目】短周期元素X、Y、Z、W的原子序数依次增大,且X、Z是同族元素,W元素的单质为淡黄色固体。它们的最高价氧化物溶于水可得四种溶液,0.010mol·L-1的这四种溶液pH与该元素原子半径的关系如右图所示。下列说法正确的是
A. W的氧化物的水化物一定是强酸
B. 气态氢化物的稳定性:Z>X
C. 简单离子半径:W>Y
D. Y与W形成的化合物一定含有共价键
【答案】C
【解析】
W元素的单质为淡黄色固体,W是S元素;0.010mol·L-1的Y的最高价氧化物水化物溶液pH=12,则Y是Na元素;0.010mol·L-1的X的最高价氧化物水化物溶液pH=2,则X是N元素,同浓度的W的最高氧化物的水化物的溶液的pH<2,则W为S元素;X、Z是同族元素,Z是P元素。
A、W是S元素,S的氧化物的水化物中,H2SO3是弱酸,故A错误;
B、同主族元素从上到下非金属性减弱,气态氢化物的稳定性减弱,所以稳定性NH3>PH3,故B错误;
C、电子层数越多,半径越大,所以简单离子半径S2->Na+,故C正确;
D、Na与S形成的化合物Na2S中不含有共价键,故D错误。

【题目】研究CO、CO2的回收利用既可变废为宝,又可减少碳的排放。回答下列问题:
(1)二甲醚(CH3OCH3)被誉为“21世纪的清洁燃料”,由CO和H2制备二甲醚的反应原理如下:
CO(g)+2H2(g)![]() CH3OH(g) ΔH=-90.1kJ/mol
CH3OH(g) ΔH=-90.1kJ/mol
2CH3OH(g)![]() CH3OCH3(g)+H2O(g) ΔH=-24.5kJ/mol
CH3OCH3(g)+H2O(g) ΔH=-24.5kJ/mol
已知:CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH=-41.0kJ/mol
CO2(g)+H2(g) ΔH=-41.0kJ/mol
则2CO2(g)+6H2(g)![]() CH3OCH3(g)+3H2O(g)的ΔH=__________,有利于提高该反应中CO2平衡转化率的条件是______(填标号)。
CH3OCH3(g)+3H2O(g)的ΔH=__________,有利于提高该反应中CO2平衡转化率的条件是______(填标号)。
A.高温低压 B.高温高压 C.低温低压 D.低温高压
(2)T1K时,将1mol二甲醚引入一个抽空的150L恒容容器中,发生分解反应: CH3OCH3(g)![]() CH4(g)+H2(g)+CO(g),在不同时间测定容器内的总压,所得数据见下表:
CH4(g)+H2(g)+CO(g),在不同时间测定容器内的总压,所得数据见下表:
反应时间t/min | 0 | 6.5 | 13.0 | 26.5 | 52.6 | ∞ |
气体总压p总/kPa | 50.0 | 55.0 | 65.0 | 83.2 | 103.8 | 125.0 |
①由表中数据计算:0~6.5min内的平均反应速率v(CH3OCH3)=_________,反应达平衡时,二甲醚的分解率为_______,该温度下平衡常数K=__________。
②若升高温度,CH3OCH3的浓度增大,则该反应为______反应(填“放热”或“吸热”),要缩短达到平衡的时间,可采取的措施有___________、__________。
(3)在T2K、1.0×104kPa下,等物质的量的CO与CH4混合气体发生如下反应: CO(g)+CH4(g)![]() CH3CHO(g),反应速率v=v正v逆=k正p(CO)·p(CH4)-k逆p(CH3CHO),k正、k逆分别为正、逆向反应速率常数,p为气体的分压(气体分压p=气体总压p总×体积分数)。用气体分压表示的平衡常数Kp=4.5×10-5(kPa)-1,则CO转化率为20%时
CH3CHO(g),反应速率v=v正v逆=k正p(CO)·p(CH4)-k逆p(CH3CHO),k正、k逆分别为正、逆向反应速率常数,p为气体的分压(气体分压p=气体总压p总×体积分数)。用气体分压表示的平衡常数Kp=4.5×10-5(kPa)-1,则CO转化率为20%时![]() =_______。
=_______。