题目内容
【题目】(一)镍具有优良的物理和化学特性,是许多领域尤其是高技术产业的重要原料。羰基法提纯粗镍涉及的两步反应依次为
①Ni(s)+4CO(g)![]() Ni(CO)4(g) ΔH<0
Ni(CO)4(g) ΔH<0
②Ni(CO)4(g)![]() Ni(s)+4CO(g) ΔH>0
Ni(s)+4CO(g) ΔH>0
完成下列填空:
(1)在温度不变的情况下,要提高反应①中Ni(CO)4的产率,可采取的措施有____、____。
(2)已知在一定条件下2L密闭容器中制备Ni(CO)4,粗镍(纯度98.5%,所含杂质不与CO反应)剩余质量和反应时间的关系如图所示。Ni(CO)4在0~10min的平均反应速率为_____。
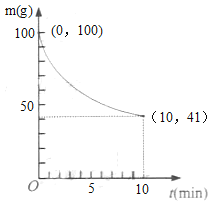
(3)若反应②达到平衡后,保持其他条件不变,降低温度,重新达到平衡时___。
a.平衡常数K增大 b.CO的浓度减小
c.Ni的质量减小 d.υ逆[Ni(CO)4]增大
(二)已知NO2和N2O4可以相互转化:2NO2(g)![]() N2O4(g) ΔH=-57kJ·mol-1,一定温度下,将1molN2O4充入一恒压密闭容器中。
N2O4(g) ΔH=-57kJ·mol-1,一定温度下,将1molN2O4充入一恒压密闭容器中。
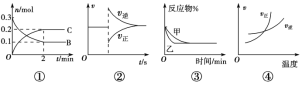
(1)下列示意图正确且能说明反应达到平衡状态的是___。
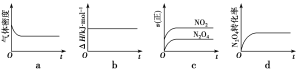
(2)若在相同温度下,上述反应改在体积为1L的恒容密闭容器中进行,平衡常数____(填“增大”“不变”或“减小”),反应3s后NO2的物质的量为0.6mol,则0~3s内的平均反应速率υ(N2O4)=___mol·L-1·s-1。
(3)达到平衡后,若向该恒压容器中再充入0.5molHe,则平衡将__(填“向左移动”“向右移动”或“不移动”)。
(4)该反应在温度分别为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是___(填字母序号)。
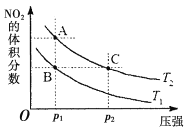
a.A、C两点气体的颜色:A深,C浅
b.A、C两点NO2的转化率:A<C
c.B、C两点的气体的平均相对分子质量:B<C
d.由状态B到状态A,可以用加热的方法
(三)丁烯是一种重要的化工原料,可由丁烷催化脱氢制备。回答下列问题:
(1)正丁烷(C4H10)脱氢制1丁烯(C4H8)的热化学方程式如下:
已知:
①C4H10(g) ![]() C4H8(g)+H2(g) ΔH1
C4H8(g)+H2(g) ΔH1
②C4H10(g)+![]() O2(g)=C4H8(g)+H2O(g) ΔH2=-119kJ·mol-1
O2(g)=C4H8(g)+H2O(g) ΔH2=-119kJ·mol-1
③H2(g)+![]() O2(g)=H2O(g) ΔH3=-242kJ·mol-1
O2(g)=H2O(g) ΔH3=-242kJ·mol-1
反应①的ΔH1为____kJ·mol-1。图(a)是反应①平衡转化率与反应温度及压强的关系图,x___0.1(填“大于”或“小于”);欲使丁烯的平衡产率提高,应采取的措施是___(填标号)。
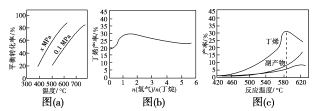
A.升高温度 B.降低温度
C.增大压强 D.降低压强
(2)丁烷和氢气的混合气体以一定流速通过填充有催化剂的反应器(氢气的作用是活化催化剂),出口气中含有丁烯、丁烷、氢气等。图(b)为丁烯产率与进料气中n(氢气)/n(丁烷)的关系。图中曲线呈现先升高后降低的变化趋势,其降低的原因是__。
【答案】增大CO浓度 加压 0.05 mol·L-1·min-1 bc ad 不变 0.1 向左移动 bd +123 小于 AD 氢气是产物之一,随着n(氢气)/n(丁烷)增大,逆反应速率增大
【解析】
(一)
(1)反应Ni(s)+4CO(g)![]() Ni(CO)4(g) ΔH<0是放热反应,正反应气体体积减小,依据平衡移动原理分析;
Ni(CO)4(g) ΔH<0是放热反应,正反应气体体积减小,依据平衡移动原理分析;
(2)粗镍的纯度98.5%,1~10min内粗镍质量减少100g-41g═59g;由于杂质与CO不反应,依据化学方程式计算Ni(CO)4物质的量得到变化浓度,根据化学反应速率概念计算得到;
(3)反应②为吸热反应,因此反应②达到平衡后,降温,平衡逆向进行,反应平衡常数K变小、CO的浓度与Ni的质量均减小、因温度降低,υ逆[Ni(CO)4]减小;
(二)
(1)根据反应的特点和化学平衡的标志分析作答;
(2)平衡常数是温度的函数,只受温度影响,故平衡常数不变;先利用公式计算υ(NO2),再用化学反应速率之比等于化学计量数之比;
(3)恒温恒压时充入稀有气体,容器容积增大,各反应成分浓度降低,反应速率减小,平衡向气体体积增大的方向移动。
(4)a.相同温度下,增大压强达到新的平衡,体系中各种物质的浓度均增大,体系颜色变深,即A浅,C深,a错误;b.增大压强,平衡右移,二氧化氮的转化率增大,b正确;c. 根据图像,B、C两点所处平衡状态中各组分的体积分数分别相等,即它们的平均相对分子质量相等,c错误;d. 该反应的正反应为放热反应,升高温度平衡逆向移动,NO2体积分数增大,则T1<T2,可以通过加热的方法由状态B移动到状态A,d正确;
(三)
(1)根据盖斯定律,②式-③式可得①式的△H1;由(a)图定温度,压强由0.1MPa变化到xMPa,丁烷的转化率增大,即平衡正向移动,结合反应前后气体体积的变化分析x;要使丁烯的平衡产率增大,需通过改变温度和压强使平衡正向移动;
(2)丁烷分解产生丁烯和氢气,增加氢气的量,①的逆反应速率增大,丁烯的产率下降。
(一)
(1)反应①是气体体积减少的放热反应,因此在温度不变的情况下,采取增大体系压强、增大CO浓度等措施均可使反应正向进行,提高Ni(CO)4的产率;故答案为:增大CO浓度;加压;
(2)1~10min内粗镍质量减少100g-41g═59g;由于杂质与CO不反应,则反应的镍的物质的量为59g÷59g/mol=1mol,在0~10min内生成Ni(CO)4的物质的量为1mol,故在0~10min,υ[Ni(CO)4]= ![]() =0.05 mol·L-1·min-1;故答案为:0.05 mol·L-1·min-1;
=0.05 mol·L-1·min-1;故答案为:0.05 mol·L-1·min-1;
(3)反应②为吸热反应,因此反应②达到平衡后,降温,平衡逆向移动;
a. 温度降低平衡向放热反应方向进行,反应②是吸热反应,平衡逆向移动,平衡常数减小,a错误;
b. 温度降低平衡向放热反应方向进行,反应②是吸热反应,平衡逆向移动,一氧化碳浓度减小,b正确;
c. 依据反应分析,温度降低反应②逆向移动,镍质量减小,c正确;
d.温度降低,υ逆[Ni(CO)4]减小,d错误;
故答案为:bc;
(二)
(1)a.正反应是气体分子数减小的反应,在温度和压强恒定的条件下,建立平衡过程中容器体积变大,气体质量不变,则气体密度变小,达到了平衡状态时混合气的密度不变,故a正确;
b.反应热ΔH只与反应方程式有关,是一个不变量,H不变不能说明反应达到平衡状态,故b错误;
c.图示NO2和N2O4表示的都是正反应速率,两者表示的正反应速率之比始终等于2:1,不能判断反应是否达到平衡状态,故c错误;
d.开始N2O4的转化率在增大,后来转化率不变,说明正逆反应速率相等,达到了平衡状态,故d正确;
正确答案是ad;
(2)平衡常数是温度的函数,只受温度影响,由于温度不变,故平衡常数不变。由题意可知,υ(NO2)=0.6mol÷1L÷3s=0.2molL-1s-1,化学反应速率之比等于化学计量数之比,故υ(N2O4)=0.1molL-1s-1;
(3)恒压容器中再充入He,体积增大,相当于减压,平衡向左移动;
(4)a. 相同温度下,增大压强虽然平衡正向移动,但体系中各种物质的浓度均增大,体系颜色变深,即A浅,C深,a错误;
b.增大压强,平衡右移,二氧化氮的转化率增大,转化率A<C,b正确;
c. 根据图像,B、C两点所处平衡状态中各组分的体积分数分别相等,即它们的平均相对分子质量相等,c错误;
d. 该反应的正反应为放热反应,升高温度平衡逆向移动,NO2体积分数增大,则T1<T2,可以通过加热的方法由状态B移动到状态A,d正确;
故选bd。
(三)
(1)②C4H10(g)+![]() O2(g)=C4H8(g)+H2
O2(g)=C4H8(g)+H2![]() O2(g)=H2O(g) ΔH3=-242kJ·mol-1,②③得①式C4H10(g)=C4H8(g)+H2(g) ΔH1= +123kJmol1;由(a)图可知温度相同时,由0.1MPa变化到xMPa,丁烷转化率增大,即平衡正向移动,该反应是气体体积增大的反应,所以x的压强更小,x<0.1;由于反应①为吸热反应,温度升高时,平衡正向移动,丁烯的平衡产率增大,反应①的正向体积增大,减压时平衡正向移动,丁烯的平衡产率增大,因此AD正确,故答案为:+123;小于;AD;
O2(g)=H2O(g) ΔH3=-242kJ·mol-1,②③得①式C4H10(g)=C4H8(g)+H2(g) ΔH1= +123kJmol1;由(a)图可知温度相同时,由0.1MPa变化到xMPa,丁烷转化率增大,即平衡正向移动,该反应是气体体积增大的反应,所以x的压强更小,x<0.1;由于反应①为吸热反应,温度升高时,平衡正向移动,丁烯的平衡产率增大,反应①的正向体积增大,减压时平衡正向移动,丁烯的平衡产率增大,因此AD正确,故答案为:+123;小于;AD;
(2)丁烷分解产生丁烯和氢气,开始氢气量较少时,氢气的作用是活化催化剂,氢气是反应①的产物之一,增大氢气的量,逆反应速率增大,丁烯的产率降低,故答案为:氢气是产物之一,随着n(氢气)/n(丁烷)增大,逆反应速率增大。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案