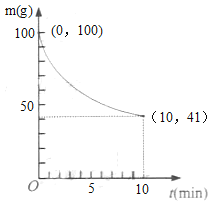题目内容
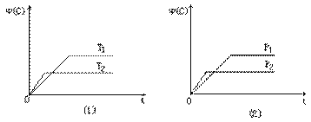
【题目】已知:25℃时,碳酸(H2CO3)的电离常数Ka1=4.5×10-7、Ka2=5.0×10-11。常温下,向20mL0.1molL-1Na2CO3溶液中逐滴加入0.1molL-1的盐酸40mL,溶液中含碳元素各微粒(CO2因逸出未画出)的物质的量分数随溶液pH的变化如图所示,下列说法错误的是( )

A.随着盐酸的加入,溶液中![]() 的值增大
的值增大
B.加入盐酸至溶液pH=8的过程中,水的电离程度逐渐减小
C.当pH=7时,溶液中c(Na+)>c(HCO3-)>cCl-)
D.当溶液中c(HCO3-):c(CO32-)=2:1时,溶液的pH=10
【答案】C
【解析】
A. 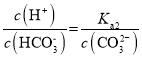 ,随着盐酸的加入,
,随着盐酸的加入,![]() 不变,
不变,![]() 减小,
减小,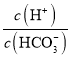 的值增大,故A正确;
的值增大,故A正确;
B. ![]() 溶液中加入适量盐酸的过程中,水的电离程度逐渐减小,故B正确;
溶液中加入适量盐酸的过程中,水的电离程度逐渐减小,故B正确;
C. 当![]() 时,反应的化学方程式为
时,反应的化学方程式为![]() ,由于
,由于![]() 水解,故
水解,故![]() ,继续加入盐酸至
,继续加入盐酸至![]() 时,
时,![]() ,故C错误;
,故C错误;
D.当溶液中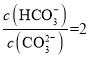 :1时,
:1时,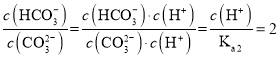 ,故
,故![]() ,溶液的
,溶液的![]() ,故D正确;
,故D正确;
综上所述,答案为C。

练习册系列答案
相关题目
【题目】某温度和有催化剂条件下,恒容密闭容器中发生反应N2+3H2 2NH3,下列说法正确的是( )
t/min | 0 | 5 | 10 | 15 | 20 |
c(NH3)/(mol·L-1) | 0 | 1.00 | 1.60 | 1.80 | 1.80 |
A. 0~10min内,v(NH3)=0.16mol·L-1·min-1 B. 0~10min内,v(N2)=0.18mol·L-1·min-1
C. 0~10min内,v(N2)=0.16mol·L-1·min-1 D. 15~20min内,反应v(N2)正= v(N2)逆=0