题目内容
【题目】已知铝土矿的主要成分是Al2O3,含有杂质SiO2(不溶于盐酸和水)、Fe2O3、MgO。工业上从铝土矿中提取铝可采用如下工艺流程:
请回答下列问题:
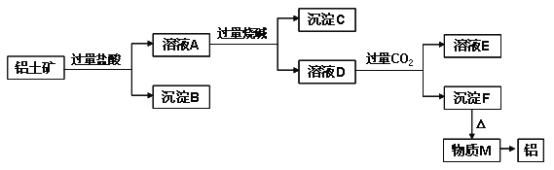
(1)溶液A转化为溶液D发生的离子方程式为________________________________。
(2)由物质M制取铝的化学方程式为________________________________________。
(3)溶液D中通入过量CO2生成沉淀F的离子方程式为________________________。
(4)沉淀C的成分是____________ ,逐滴向少量沉淀C中加入过量盐酸至沉淀全部溶解,此过程的实验现象为_______________________________________________。
【答案】 Al3++4OH-=AlO2-+2H2O 2Al2O3![]() 4Al + 3O2↑ AlO2-+CO2+2H2O=Al(OH)3↓+HCO3- Fe(OH)3 Mg(OH)2 沉淀全部溶解,溶液变为棕黄色
4Al + 3O2↑ AlO2-+CO2+2H2O=Al(OH)3↓+HCO3- Fe(OH)3 Mg(OH)2 沉淀全部溶解,溶液变为棕黄色
【解析】加入盐酸后二氧化硅不溶,沉淀B是二氧化硅,A中含有氯化铝、氯化镁、氯化铁以及过量的盐酸。加入过量的氢氧化钠后,生成氢氧化铁、氢氧化镁沉淀以及偏铝酸钠和氯化钠,通入过量的二氧化碳后偏铝酸钠转化为氢氧化铝沉淀,同时还有碳酸氢钠生成。氢氧化铝分解生成氧化铝和水,电解熔融的氧化铝得到金属铝。
(1)根据以上分析可知溶液A转化为溶液D发生的离子方程式为Al3++4OH-=AlO2-+2H2O。(2)根据以上分析可知由物质M制取铝的化学方程式为2Al2O3![]() 4Al + 3O2↑。(3)根据以上分析可知溶液D中通入过量CO2生成沉淀F的离子方程式为AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-。(4)根据以上分析可知沉淀C的成分是Fe(OH)3、Mg(OH)2,逐滴向少量沉淀C中加入过量盐酸至沉淀全部溶解,氢氧化铁转化为氯化铁,氢氧化镁转化为氯化镁,所以此过程的实验现象为沉淀全部溶解,溶液变为棕黄色。
4Al + 3O2↑。(3)根据以上分析可知溶液D中通入过量CO2生成沉淀F的离子方程式为AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-。(4)根据以上分析可知沉淀C的成分是Fe(OH)3、Mg(OH)2,逐滴向少量沉淀C中加入过量盐酸至沉淀全部溶解,氢氧化铁转化为氯化铁,氢氧化镁转化为氯化镁,所以此过程的实验现象为沉淀全部溶解,溶液变为棕黄色。

【题目】工业上用闪锌矿(主要成分为ZnS,还含有CdS、Fe2O3等杂质)为原料生产ZnSO47H2O的工艺流程如下:(己知Cd的金属活动性介于Zn和Fe之间)
(1)从滤渣A中可获得一种淡黄色非金属单质的副产品,其化学式为 .
(2)浸取过程中Fe2(SO4)3的作用是 , 浸取时Fe2(SO4)3与ZnS发生反应的化学方程式为 .
(3)除铁过程控制溶液的pH在5.4左右,该反应的离子方程式为 . 该过程在空气入口处设计了一个类似淋浴喷头的装置,其目的是 .
(4)置换法除重金属离子是Cd2+ , 所用物质C为 .
(5)硫酸锌的溶解度与温度之间的关系如下表:
温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 |
溶解度/g | 41.8 | 54.1 | 70.4 | 74.8 | 67.2 | 60.5 |
从除重金属后的硫酸锌溶液中获得硫酸锌晶体的实验操作为、、过滤、干燥.