题目内容
【题目】高纯六水氯化锶晶体(SrCl26H2O)具有很高的经济价值,工业上用难溶于水的碳酸锶(SrCO3)为原料(含少量钡和铁的化合物等),制备高纯六水氯化锶晶体的过程为: 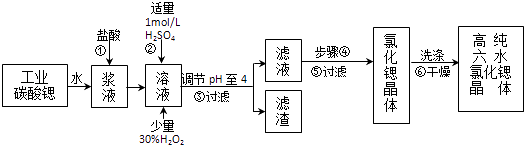
已知:Ⅰ.SrCl26H2O晶体在61℃时开始失去结晶水,100℃时失去全部结晶水.
Ⅱ.有关氢氧化物开始沉淀和完全沉淀的pH表:
氢氧化物 | Fe(OH)3 | Fe(OH)2 |
开始沉淀的pH | 1.5 | 6.5 |
沉淀完全的pH | 3.7 | 9.7 |
(1)操作①加快反应速率的措施有(写一种).碳酸锶与盐酸反应的离子方程式 .
(2)酸性条件下,加入30% H2O2溶液,将Fe2+氧化成Fe3+ , 其离子方程式为 .
(3)在步骤②﹣③的过程中,将溶液的pH值由1调节至4时,宜用的试剂为
A.氨水
B.氢氧化锶粉末
C.氢氧化钠
D.碳酸钠晶体
(4)操作③中所得滤渣的主要成分是(填化学式).
(5)步骤④的操作是、 .
(6)工业上用热风吹干六水氯化锶,适宜的温度是
A.50~60℃
B.70~80℃
C.80~100℃
D.100℃以上.
【答案】
(1)加热、充分搅拌、适当增加盐酸浓度等;SrCO3+2H+=Sr2++CO2↑+H2O
(2)2Fe2++H2O2+2H+=2Fe3++2H2O
(3)B
(4)Fe(OH)3、BaSO4
(5)蒸发浓缩;冷却结晶
(6)A
【解析】解:以SrCO3为原料制备六水氯化锶(SrCl26H2O),由流程可知,SrCO3和盐酸反应后溶液中除含有Sr2+和Cl﹣外,还含有少量Fe2+、Ba2+杂质,然后加硫酸生成硫酸钡沉淀,加入过氧化氢,调节溶液pH可生成氢氧化铁沉淀,所以过滤后滤渣为硫酸钡和氢氧化铁,滤液中含SrCl2 , 最后蒸发、冷却结晶得到SrCl26H2O,(1)增大反应速率,则增大浓度,加热,或者搅拌,增大接触面积,碳酸锶与盐酸反应生成氯化锶、二氧化碳和水,反应的离子方程式为SrCO3+2H+=Sr2++CO2↑+H2O, 所以答案是:加热、充分搅拌、适当增加盐酸浓度等;SrCO3+2H+=Sr2++CO2↑+H2O;(2)酸性条件下,加入30% H2O2溶液,将Fe2+氧化成Fe3+ , 同时生成水,反应的离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O,
所以答案是:2Fe2++H2O2+2H+=2Fe3++2H2O;(3)调节pH除去Fe3+等,要不能引入杂质,最好选用氢氧化锶粉末或氧化锶粉末,所以答案是:B;(4)由于前面加入了稀硫酸故有硫酸钡生成,水解可生成氢氧化铁沉淀,所以沉淀有两种即BaSO4、Fe(OH)3 , 所以答案是:Fe(OH)3、BaSO4;(5)由滤液得到晶体,应经过蒸发浓缩、冷却结晶等操作,所以答案是:蒸发浓缩、冷却结晶;(6)六水氯化锶晶体61℃时开始失去结晶水,100℃时失去全部结晶水,则用热风吹干六水氯化锶,选择的适宜温度范围是50~60℃,所以答案是:A.

 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案【题目】丁醛是一种化工原料.某实验小组利用如下装置合成正丁醛.发生的反应如图:
CH3CH2CH2CH2OH ![]() CH3CH2CH2CHO
CH3CH2CH2CHO
反应物和产物的相关数据列表如表:
沸点/℃ | 密度/(gcm﹣3) | 水中溶解性 | |
正丁醇 | 117.2 | 0.810 9 | 微溶 |
正丁醛 | 75.7 | 0.801 7 | 微溶 |
实验步骤如下:
将6.0g Na2Cr2O7放入100mL烧杯中,加30mL水溶解,再缓慢加入5mL浓硫酸,将所得溶液小心转移到B中.在A中加入4.0g正丁醇和几粒沸石,加热.当有蒸汽出现时,开始滴加B中溶液.滴加过程中保持反应温度为90~95℃,在E中收集90℃以下的馏分.
将馏出物倒入分液漏斗中,分去水层,有机层干燥后蒸馏,收集75~77℃馏分,产量2.0g.
回答下列问题:
(1)实验中,(填“能”或“否”)将Na2Cr2O7溶液加到浓硫酸中.
(2)正丁醇在Cu/Ag,O2、加热条件下也可氧化为丁醛,反应的化学方程式为 .
(3)上述装置图中,D仪器的名称是 . 加入沸石的作用是 . 若加热后发现未加沸石,应采取的正确方法是 .
(4)分液漏斗使用前必须进行的操作是 (填正确答案标号).
A.润湿
B.干燥
C.检漏
D.标定
(5)将正丁醛粗产品置于分液漏斗中分水时,水在层(填“上”或“下”).
(6)本实验中,正丁醛的产率为%.(相对原子质量:C 12 H 1 O 16)
