题目内容
【题目】某研究性学习小组用如图装置进行SO2与FeCl3溶液反应的相关实验(夹持装置已略去). 
(1)在配制氯化铁溶液时,需先把氯化铁晶体溶解在中,再加水稀释.
(2)组装仪器按气流方向正确的连接顺序是a接 , 接 , 接 .
(3)烧杯中倒置漏斗的作用是 .
(4)往FeCl3溶液中通入足量SO2时,观察到的现象为 .
(5)根据以上现象,该小组同学认为SO2与FeCl3溶液发生了氧化还原反应. ①写出SO2与FeCl3溶液反应的离子方程式:;
②请设计实验方案检验有Fe2+生成:;
③该小组同学向盛装FeCl3试管反应后的溶液中加入硝酸酸化的BaCl2溶液,若出现白色沉淀,即可证明反应生成了SO42﹣ . 该做法不合理,理由是 .
【答案】
(1)浓盐酸
(2)d;e;c;b;f
(3)使气体充分吸收,防止溶液倒吸
(4)溶液由棕黄色变为浅绿色
(5)2Fe3++SO2+2H2O=SO42﹣+4H++2Fe2+;取C中反应后的溶液,向其中滴入KSCN溶液,不变红,再加入新制的氯水,溶液变红;硝酸可以将溶解的SO2氧化为H2SO4 , 干扰试验
【解析】解:(1)配制氯化铁溶液时,需先把氯化铁晶体溶解在浓盐酸中,再加水稀释,这样操作的目的是抑制铁离子水解,所以答案是:浓盐酸;(2)根据实验目的,先是制备二氧化硫,用第一个装置,用最后一个装置,导管要短进长出,可以防止倒吸,然后是让二氧化硫和氯化铁之间反应,即第三个装置,最后进行尾气处理,顺序是:d、e、c、b、f,所以答案是:d;e;c;b;f;(3)因尾气易溶于NaOH溶液,则倒置漏斗的作用为防止NaOH溶液倒吸,所以答案是:使气体充分吸收,防止溶液倒吸;(4)通入足量SO2时C中发生二氧化硫与氯化铁的氧化还原反应,生成硫酸亚铁,则观察到溶液由棕黄色变为浅绿色,所以答案是:溶液由棕黄色变为浅绿色;(5)①发生氧化还原反应,生成硫酸根离子、亚铁离子,离子反应为2Fe3++SO2+2H2O=SO42﹣+4H++2Fe2+ , 所以答案是:2Fe3++SO2+2H2O=SO42﹣+4H++2Fe2+;②检验有Fe2+生成的实验方法为取C中反应后的溶液,向其中滴入KSCN溶液,不变红,再加入新制的氯水,溶液变红, 所以答案是:取C中反应后的溶液,向其中滴入KSCN溶液,不变红,再加入新制的氯水,溶液变红;③该小组同学向C试管反应后的溶液中加入硝酸酸化的BaCl2溶液,硝酸具有强氧化性,则硝酸可以将溶解的SO2氧化为 H2SO4 , 干扰试验,故做法不合理,
所以答案是:硝酸可以将溶解的SO2氧化为H2SO4 , 干扰试验.

 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案【题目】高纯六水氯化锶晶体(SrCl26H2O)具有很高的经济价值,工业上用难溶于水的碳酸锶(SrCO3)为原料(含少量钡和铁的化合物等),制备高纯六水氯化锶晶体的过程为: 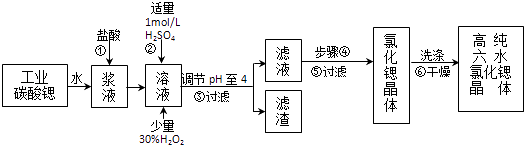
已知:Ⅰ.SrCl26H2O晶体在61℃时开始失去结晶水,100℃时失去全部结晶水.
Ⅱ.有关氢氧化物开始沉淀和完全沉淀的pH表:
氢氧化物 | Fe(OH)3 | Fe(OH)2 |
开始沉淀的pH | 1.5 | 6.5 |
沉淀完全的pH | 3.7 | 9.7 |
(1)操作①加快反应速率的措施有(写一种).碳酸锶与盐酸反应的离子方程式 .
(2)酸性条件下,加入30% H2O2溶液,将Fe2+氧化成Fe3+ , 其离子方程式为 .
(3)在步骤②﹣③的过程中,将溶液的pH值由1调节至4时,宜用的试剂为
A.氨水
B.氢氧化锶粉末
C.氢氧化钠
D.碳酸钠晶体
(4)操作③中所得滤渣的主要成分是(填化学式).
(5)步骤④的操作是、 .
(6)工业上用热风吹干六水氯化锶,适宜的温度是
A.50~60℃
B.70~80℃
C.80~100℃
D.100℃以上.
