��Ŀ����
����Ŀ����ȩ��һ�ֻ���ԭ�ϣ�ijʵ��С����������װ�úϳ�����ȩ�������ķ�Ӧ��ͼ��
CH3CH2CH2CH2OH ![]() CH3CH2CH2CHO
CH3CH2CH2CHO
��Ӧ��Ͳ������������б������
�е�/�� | �ܶ�/��gcm��3�� | ˮ���ܽ��� | |
������ | 117.2 | 0.810 9 | �� |
����ȩ | 75.7 | 0.801 7 | �� |
ʵ�鲽�����£�
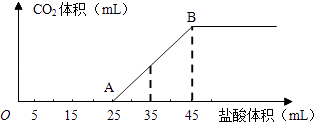
��6.0g Na2Cr2O7����100mL�ձ��У���30mLˮ�ܽ⣬�ٻ�������5mLŨ���ᣬ��������ҺС��ת�Ƶ�B�У���A�м���4.0g�������ͼ�����ʯ�����ȣ�������������ʱ����ʼ�μ�B����Һ���μӹ����б��ַ�Ӧ�¶�Ϊ90��95�棬��E���ռ�90�����µ���֣�
������ﵹ���Һ©���У���ȥˮ�㣬�л������������ռ�75��77����֣�����2.0g��
�ش��������⣺
��1��ʵ���У�����ܡ�����Na2Cr2O7��Һ�ӵ�Ũ�����У�
��2����������Cu/Ag��O2������������Ҳ������Ϊ��ȩ����Ӧ�Ļ�ѧ����ʽΪ ��
��3������װ��ͼ�У�D������������ �� �����ʯ�������� �� �����Ⱥ���δ�ӷ�ʯ��Ӧ��ȡ����ȷ������ ��
��4����Һ©��ʹ��ǰ������еIJ������� ��������ȷ�𰸱�ţ���
A.��ʪ
B.����
C.��©
D.�궨
��5��������ȩ�ֲ�Ʒ���ڷ�Һ©���з�ˮʱ��ˮ���㣨��ϡ����¡�����
��6����ʵ���У�����ȩ�IJ���Ϊ%�������ԭ��������C 12 H 1 O 16��
���𰸡�
��1����
��2��2CH3CH2CH2CH2OH+O2 ![]() 2CH3CH2CH2CHO+2H2O
2CH3CH2CH2CHO+2H2O
��3��������,��ֹ����,��ȴ��
��4��C
��5����
��6��51
���������⣺��1����ΪŨ������ܶȴ�Na2Cr2O7��Һ�ӵ�Ũ�����У��������Ž���
��2����������Cu/Ag��O2�����������·�����������������������ȩ��ˮ����ӦΪ��2CH3CH2CH2CH2OH+O2 ![]() 2CH3CH2CH2CHO+2H2O��
2CH3CH2CH2CHO+2H2O��
��3��D����Ϊ��������������Ϊ�����ܣ���ʯ�������ɶ�ף��ܷ�ֹ�е�͵�Һ�屩�У����Լ����ʯ�������Ƿ�ֹ���У������Ⱥ���δ�ӷ�ʯ����ȫ�����Ӧ����ȴ�ӣ�
��4����Һ©�����Ͽ����Ӻ��¿��п���Һ�������Ļ�������ʹ��ǰ��Ҫ����Ƿ�©ˮ��
��5������ȩ�ܶ�Ϊ0.8017 gcm��3��С��ˮ���ܶȣ��ʷֲ�ˮ�����·���
��6��������ȩ�IJ���Ϊx������������������Ϊx�����ݹ�ϵʽ��
C4H10O�� | C4H8O |
74 | 72 |
4xg | 2g |
��ã�x= ![]() =51%��
=51%��
�ʴ�Ϊ����1����2��2CH3CH2CH2CH2OH+O2 �� �� C u / A g 2CH3CH2CH2CHO+2H2O����3�������ܣ���ֹ���У���ȴ�ӣ���4��C�� ��5���£���6��51
��1��Ũ������ܶȱ�ˮ��Һ���ܶȴ������Լ�ʱ��Ӧ��Ũ���ᵹ��ˮ��Һ�У�
��2��������Cu/Ag��O2�����������±�������ȩ��ע�ⷴӦԭ�����ж��Լ�����ʽ����ƽ��
��3��������Һʱ��Ϊ��ֹҺ�屬�У�Ӧ�����ʯ�������Ⱥ���δ�����ʯ��Ӧʹ��Һ��ȴ�����º��ټ��룻
��4����Һ©��ʹ��ǰ�������Ƿ�©ˮ��
��5������������ṩ�����ݣ�����ȩ���ܶȱ�ˮС��
��6�����ݹ�ʽ����=m(ʵ�ʲ���)��m(���۲���)��100%���ɷ���ʽ��������۲�������Ϲ�ʽ���ɵó����ʡ�

 ���Ͱ�ͨ�������Сѧ��ʱͬ�����ϵ�д�
���Ͱ�ͨ�������Сѧ��ʱͬ�����ϵ�д� ���Ͱ�ͨ������ϵ�д�
���Ͱ�ͨ������ϵ�д�����Ŀ���ߴ���ˮ�Ȼ��Ⱦ��壨SrCl26H2O�����кܸߵľ��ü�ֵ����ҵ����������ˮ��̼���ȣ�SrCO3��Ϊԭ�ϣ��������������Ļ�����ȣ����Ʊ��ߴ���ˮ�Ȼ��Ⱦ���Ĺ���Ϊ�� 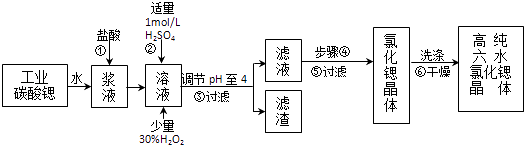
��֪����SrCl26H2O������61��ʱ��ʼʧȥ�ᾧˮ��100��ʱʧȥȫ���ᾧˮ��
���й��������↑ʼ��������ȫ������pH����
�������� | Fe��OH��3 | Fe��OH��2 |
��ʼ������pH | 1.5 | 6.5 |
������ȫ��pH | 3.7 | 9.7 |
��1�������ټӿ췴Ӧ���ʵĴ�ʩ����дһ�֣���̼���������ᷴӦ�����ӷ���ʽ ��
��2�����������£�����30% H2O2��Һ����Fe2+������Fe3+ �� �����ӷ���ʽΪ ��
��3���ڲ���ک��۵Ĺ����У�����Һ��pHֵ��1������4ʱ�����õ��Լ�Ϊ
A.��ˮ
B.�������ȷ�ĩ
C.��������
D.̼���ƾ���
��4����������������������Ҫ�ɷ������ѧʽ����
��5������ܵIJ������� ��
��6����ҵ�����ȷ紵����ˮ�Ȼ��ȣ����˵��¶���
A.50��60��
B.70��80��
C.80��100��
D.100�����ϣ�