题目内容
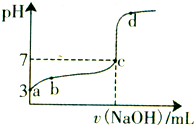 常温下,向20mL 0.1moL/L CH3COOH溶液中逐滴加入0.1mol/L NaOH溶液,其pH变化曲线如图所示(忽略温度变化).下列说法不正确的是( )
常温下,向20mL 0.1moL/L CH3COOH溶液中逐滴加入0.1mol/L NaOH溶液,其pH变化曲线如图所示(忽略温度变化).下列说法不正确的是( )| A、a点表示的溶液中c(OH-)=10-11mol/L | ||
B、a、b点表示的溶液中
| ||
| C、c点表示CH3COOH和NaOH恰好完全反应c(CH3COOH)?c(OH-) | ||
| D、d点表示的溶液中c(Na+)>c(CH3COO-) |
分析:A、根据溶液中水的离子积表达式来计算;
C、从溶液电中性的角度分析;
C、根据酸的电离平衡常数以及水的离子积表达式来回答;
D、根据氢氧化钠和醋酸钠溶液中离子浓度的大小关系来回答.
C、从溶液电中性的角度分析;
C、根据酸的电离平衡常数以及水的离子积表达式来回答;
D、根据氢氧化钠和醋酸钠溶液中离子浓度的大小关系来回答.
解答:解:A、a点是c(H+)=10-3mol/L,根据Kw=c(H+)?c(OH-),所以溶液中c(OH-)=10-11mol/L,故A正确;
B、a、b点表示的溶液中
,上下均乘以氢离子浓度,则为
,温度不变结果是相等的,故B正确;
C、醋酸和氢氧化钠反应生成醋酸钠,醋酸钠是强碱弱酸盐其水溶液呈碱性,当酸碱恰好反应时溶液应该呈碱性,但C点溶液呈中性,说明酸过量,故C错误;
D、d点所的溶液是氢氧化钠和醋酸钠溶液的混合物,所以c(Na+)>c(CH3COO-),故D正确.
故选C.
B、a、b点表示的溶液中
| c(CH3COO-) |
| c(CH3COOH)?c(OH-) |
| Ka |
| Kw |
C、醋酸和氢氧化钠反应生成醋酸钠,醋酸钠是强碱弱酸盐其水溶液呈碱性,当酸碱恰好反应时溶液应该呈碱性,但C点溶液呈中性,说明酸过量,故C错误;
D、d点所的溶液是氢氧化钠和醋酸钠溶液的混合物,所以c(Na+)>c(CH3COO-),故D正确.
故选C.
点评:本题考查了酸碱混合的定性判断,题目难度中等,注意知识的归纳和整理是关键.

练习册系列答案
相关题目
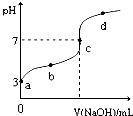 已知常温下CH3COOH的电离平衡常数为Ka,常温下,向20mL 0.1mol?L-1 CH3COOH溶液中逐滴加入0.1mol?L-1NaOH溶液,其pH变化曲线如图所示(忽略温度变化).下列说法中正确的是( )
已知常温下CH3COOH的电离平衡常数为Ka,常温下,向20mL 0.1mol?L-1 CH3COOH溶液中逐滴加入0.1mol?L-1NaOH溶液,其pH变化曲线如图所示(忽略温度变化).下列说法中正确的是( )| A、a点表示的溶液中由水电离出的H+浓度为1.0×10-3mol?L-1 | ||
| B、b点表示的溶液c(CH3COO-)<c(Na+) | ||
| C、c点表示CH3COOH和NaOH恰好反应完全 | ||
D、b、d点表示的溶液中
|
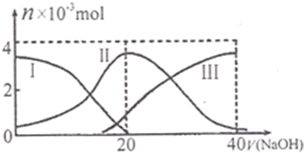
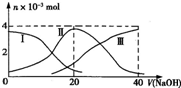 常温下,向20mL 0.2mol?L-1 H2SO3,溶液中滴加0.2mol?L-1 NaOH溶液.有关微粒的物质的量变化曲线如图所示.(其中I代表H2SO3、Ⅱ代表HS
常温下,向20mL 0.2mol?L-1 H2SO3,溶液中滴加0.2mol?L-1 NaOH溶液.有关微粒的物质的量变化曲线如图所示.(其中I代表H2SO3、Ⅱ代表HS| O | - 3 |
| O | 2- 3 |
| A、当V(NaOH)=0时,由水电离出的c(H+)=1.0×10-12?? | ||||
B、当V(NaOH)=20 mL时:c(Na+)>c(HS
| ||||
C、当V(NaOH)=40 mL时2c(Na+)=c(S
| ||||
| D、当V(NaOH)=40 mL后,继续滴加NaOH溶液,溶液的温度会继续升高 |
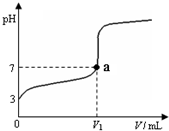 (2011?姜堰市二模)常温下,向20mL x mol?L-1 CH3COOH溶液中逐滴加入等物质的量浓度的NaOH溶液,混合液的pH随NaOH溶液的体积(V)的变化关系如图所示(忽略温度变化).下列说法中正确的是( )
(2011?姜堰市二模)常温下,向20mL x mol?L-1 CH3COOH溶液中逐滴加入等物质的量浓度的NaOH溶液,混合液的pH随NaOH溶液的体积(V)的变化关系如图所示(忽略温度变化).下列说法中正确的是( )